
(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g)CH3OH(g)ΔH=-90.8 kJ·mol-1 K1
② 2CH3OH(g)CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 K2
③ CO(g) + H2O(g)CO2(g)+ H2(g);ΔH=-41.3 kJ·mol-1 K3
总反应:3H2(g) +3CO(g)CH3OCH3(g) +CO2 (g)的ΔH= _____ , K= (用包含K1、 K2、 K3的式子表示).一定条件下的等容密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.高温高压 b.加入催化剂 c减少CO2的浓度
d.增加CO的浓度 e.增加H2的浓度 f.充入He
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v(正) ______ v(逆) (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)= _________,该时间内反应速率v(CH3OH) = __________。
(1) C+H2O![]() CO+H2 (2)-246.4kJ· mol -1;K12·K2· K3 ;c、e
CO+H2 (2)-246.4kJ· mol -1;K12·K2· K3 ;c、e
(3) ①> ②0.04 mol·L-1 ;0.16 mol·L-1·min-1(每格2分)
解析:(1)煤气化主要是在高温下煤和水蒸气反应合成水煤气,所以方程式为
C+H2O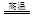 CO+H2。
CO+H2。
(2)考查盖斯定律的应用和平衡常数的计算。①×2+②+③即得到
3H2(g)+ 3CO(g)CH3OCH3(g) +CO2 (g),所以ΔH等于-(90.8×2+23.5+41.3)kJ·mol-1 =-246.4kJ·mol -1。根据①×2+②+③可计算平衡常数为K=K12·K2· K3。因为反应是体积减小的、放热的可逆反应,高温向逆反应方向移动,催化剂不能改变平衡状态,降低生成物浓度平衡向正反应方向移动,增加CO的浓度平衡向正反应方向移动,但后降低自身的转化率,增大氢气浓度可以提高CO的转化率,保持体积不变,充入稀有气体,平衡不移动,因此答案是ce。
(3)根据数据可计算出![]() ,小于平衡常数,因而正反应速率大逆反应速率。因为最初加入的甲醇是1.64mol·L-1,所以根据反应式可进行计算。
,小于平衡常数,因而正反应速率大逆反应速率。因为最初加入的甲醇是1.64mol·L-1,所以根据反应式可进行计算。
2CH3OH(g) CH3OCH3(g) + H2O(g)
起始浓度(mol·L-1) 1.64 0 0
转化浓度(mol·L-1) x 0.5x 0.5x
平衡浓度(mol·L-1) 1.64-x 0.5x 0.5x
所以![]()
解得x=1.6。所以平衡时c(CH3OH)等于0.04mol·L-1。反应速率v(CH3OH) 等于0.16mol·L-1·min-1。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)| 0.03 |
| t |
| 0.03 |
| t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
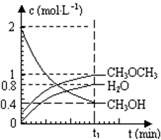 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学键 | C-H | O-H | H-H | C-O | C≡O |
| 键能/kJ.mol-1 | 413 | 463 | 436 | 358 | 1072 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 2 | 0.2 | 0 |
| 平衡浓度/mol.l-1 | 0.4 | 1 | 0.8 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 0.4 | 1.2 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com