
|
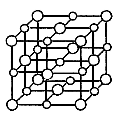
如图所示,食盐晶体由钠离子和氯离子构成.已知食盐的M=58.5 g·mol-1,食盐的密度是2.2 g·cm-3,阿伏加德罗常数为6.0×1023 mol-1,在食盐晶体中两个距离最近的钠离子中心间的距离最接近下列哪个数据
| |
| [ ] | |
A. |
3.0×10-8 cm |
B. |
3.5×10-8 cm |
C. |
4.0×10-8 cm |
D. |
5.0×10-8 cm |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:全程教与学 题型:038
如图所示,食盐(NaCl)晶体是由钠离子和氯离子组成,且都是等距交错排列.已知食盐的摩尔质量为58.5g·![]() ,食盐的密度是 2.2g·
,食盐的密度是 2.2g·![]() ,阿伏加德罗常数为6.0×1023
,阿伏加德罗常数为6.0×1023![]() ,在食盐晶体中两个距离最近的钠离子中心间的距离最接近于下面四个数值中的哪一个
,在食盐晶体中两个距离最近的钠离子中心间的距离最接近于下面四个数值中的哪一个
查看答案和解析>>
科目:高中化学 来源:2012—2013学年广西省柳铁一中高二下学期第一次月考化学试卷(带解析) 题型:填空题
(9分)㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。
⑴该结构与 的结构相似(填选项字母,下同)
A.NaCl B.CsCl C.干冰 D.SiO2
⑵钾、氧两元素所形成化合物的化学式是
A.K2O B.K2O2 C.K2O3 D.KO2
⑶下列对KO2晶体结构的描述正确的是
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图:
⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,观察到滤纸d端的电极反应式是 ;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。
则Cu2+、Y3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则电极C端的实验现象是_____ 。
查看答案和解析>>
科目:高中化学 来源:2014届广西省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(9分)㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。

⑴该结构与 的结构相似(填选项字母,下同)
A.NaCl B.CsCl C.干冰 D.SiO2
⑵钾、氧两元素所形成化合物的化学式是
A.K2O B.K2O2 C.K2O3 D.KO2
⑶下列对KO2晶体结构的描述正确的是
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图:

⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,观察到滤纸d端的电极反应式是 ;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。

则Cu2+、Y3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则电极C端的实验现象是_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com