
科目: 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
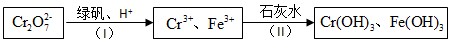
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com