
科目: 来源: 题型:实验题
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
查看答案和解析>>
科目: 来源: 题型:实验题
 碳氧化物研究
碳氧化物研究| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目: 来源: 题型:解答题
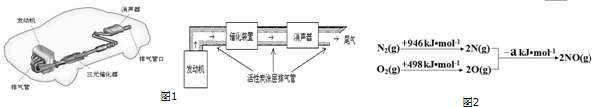
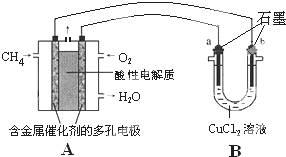 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.查看答案和解析>>
科目: 来源: 题型:解答题
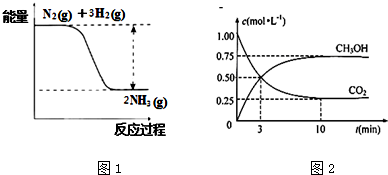
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ•mol-1 | a | b | c |


查看答案和解析>>
科目: 来源: 题型:解答题
 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.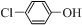 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com