
科目: 来源: 题型:解答题
 现有部分元素的存在,性质和原子结构如下所述:
现有部分元素的存在,性质和原子结构如下所述:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
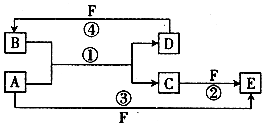 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,与同浓度的硫酸反应析出流沉淀所需的时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率增大 |
| B | 用铜作电极电解CuSO4溶液,CuSO4溶液浓度不变 | Cu2+没有参与电极反应 |
| C | 在常温下N2不能与O2反应,而白磷却能自燃 | 氮元素的非金属性比磷元素的弱 |
| D | 醋酸能与碱反应 | 醋酸分子一定不能存在于碱性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 900℃时,该反应的平衡常数K<1 | |
| B. | 850℃时,若x=5,则起始时反应向逆反应方向进行 | |
| C. | 850℃时,若要使上述反应开始时向正反应方向进行,则x应满足0≤x<3 | |
| D. | 850℃时,已知x>3,则随着x的增大,H2的转化率一定始终增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相等 | B. | ①更多 | C. | ②更多 | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在含有大量Fe3+的溶液中:Na+,SCN-,SO42-,NO3- | |
| B. | 在pH=1的溶液中:Fe3+,Mg2+,Cl-,SO42- | |
| C. | 在加入了FeSO4•7H2O晶体溶液中:Na+,H+,Cl-,NO3- | |
| D. | 能使紫色石蕊试液变红的溶液中:K+,HCO3-,NO3-,S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com