
科目: 来源: 题型:选择题
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
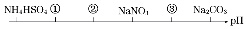 相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )| A. | NH4Cl、(NH4)2SO4、CH3COONa | B. | (NH4)2SO4、NH4Cl、CH3COONa | ||
| C. | (NH4)2SO4、NH4Cl、NaOH | D. | CH3COONa、NH4Cl、(NH4)2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
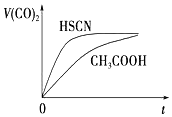 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 将水加热,Kw增大,pH增大,仍呈中性 | |
| C. | 向0.1mol/L醋酸溶液中加水,溶液中水电离产生的c(H+)将减小 | |
| D. | 向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com