
科目: 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅单既能与氢氧化钠反应又能与氢氟酸反应,所以硅具有两性 | |
| C. | 晶体硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 |
查看答案和解析>>
科目: 来源: 题型:计算题
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
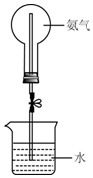 某学习小组研究氨气的喷泉实验.
某学习小组研究氨气的喷泉实验.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
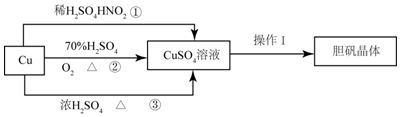
查看答案和解析>>
科目: 来源: 题型:解答题
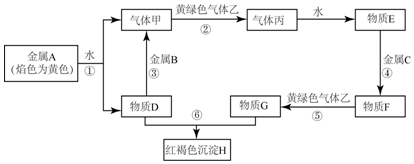
查看答案和解析>>
科目: 来源: 题型:解答题
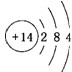 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 阴离子 | SO42-、NO3-、CO32-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
| A. | 若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色沉淀生成 | |
| B. | 原溶液中含有的阳离子为Fe2+、Al3+ | |
| C. | 用排水法可收集所产生的气体体积为$\frac{22.4}{3}$L | |
| D. | a=160 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 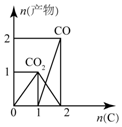 图:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 | |
| B. | 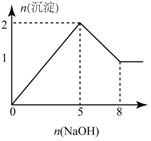 图:向含有1molMgCl2和1molAlCl3混合溶液中滴加NaOH,产生沉淀物质的量 | |
| C. | 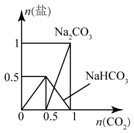 图:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| D. | 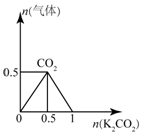 图:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敲口容器中生成的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com