
科目: 来源: 题型:选择题
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:解答题

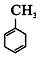 的官能团名称为碳碳双键.
的官能团名称为碳碳双键. 的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
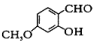 中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.
中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.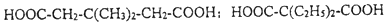 .
.
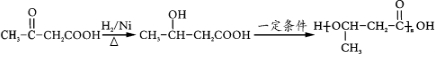 .(无机试剂任用)
.(无机试剂任用)查看答案和解析>>
科目: 来源: 题型:实验题
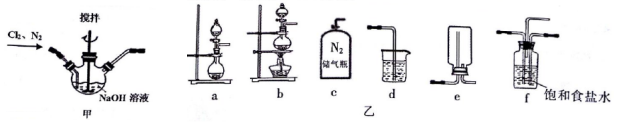
查看答案和解析>>
科目: 来源: 题型:选择题
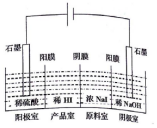 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )| A. | 通电后,阴极室溶液pH增大 | |
| B. | 阳极电极反应式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol产品HI,阳极室溶液质量减少8g | |
| D. | 通电过程中,NaI的浓度逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SiO3溶液的pH | Na2SiO3溶液的pH大 | 非金属性:C>Si |
| B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备CO2 |
| C | 将4mL 0.01mol/L酸性KMnO4溶液与2mL 0.lmol/L草酸溶液混合 | KMnO4溶液褪色的速率先慢后加快 | 增大反应物浓度, 反应速率加快 |
| D | 将NO2气体通入石蕊试液中 | 溶液变红 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | Y元素的氧化物对应的水化物一定是强酸 | |
| C. | M与R可形成含非极性键的化合物 | |
| D. | 固体X2Y3可在水溶液中制取 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 原子总数是4NA的N2与CO混合物,其质量是56g | |
| C. | Na2O2和KMnO4分别制得1molO2,转移的电子数均是2NA | |
| D. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用pH试纸测得NaC1O溶液的pH为10 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液与NaHCO3溶液 | |
| C. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显现象 | |
| D. | 向K2Cr2O7溶液中滴加NaOH溶液,溶液逐渐变黄 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅太阳能电池利用的是原电池原理 | B. | 草木灰与硝酸铵混成复合肥施用 | ||
| C. | 硅胶可用作瓶装药品的干燥剂 | D. | 用于发酵的小苏打属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com