
科目: 来源: 题型:选择题
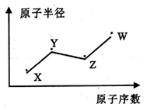 X、Y、Z、W是四种常.见的短周期主族元素,其原子半径随原子序数的变化如图所示,己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常.见的短周期主族元素,其原子半径随原子序数的变化如图所示,己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | B. | Y、W的最简单氢化物能相互反应 | ||
| C. | 非金属性:Z<Y | D. | X、Z、W形成的化合物均为强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准况状下,44.8 L四氯筑化碳含有的分子数为2NA | |
| B. | 0.1mol/L氯化铝溶液中含有Al3+数为0.1 NA | |
| C. | 1.8 g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物品标签 |  |  |  |  |
| 分析 | 该试剂应装在橡 胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 受热易分解 | 该药品标签上还标有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | (NH4) 2Fe (SO4) 2溶液与过量NaOH 溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向 NaAlO2溶液中通过里 CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性 KMnO4 氧化 H2O2:MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| B. | 氮元素的非金属性强于磷,氮气活泼性也强于磷 | |
| C. | 农村用明矾净化水,是利用其中Al (OH) 3胶体的吸附性 | |
| D. | NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上,采用电解MgCl2溶液的方法制取金属镁 | |
| B. | 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 硬币材质一般都是合金,所有的不锈钢中都含有非金属元素 | |
| D. | 使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com