现有一包由NaOH和CaCO3组成的样品50克,欲测定其中CaCO3的含量,方案有很多.现列出学生讨论出的几种结果,请阅读分析后回答相关问题.
方案一:将样品经溶解、过滤、洗涤、烘干等操作后,称量固体质量.
假如固体的测定值为10克,则w(CaCO3)=______.
方案二:在样品中加入足量稀盐酸,收集到CO211克(不考虑CO2的损耗).则:
(1)样品中w(CaCO3)=______.
(2)为了尽量减少实验误差,CO2最好采用_______收集.
方案三:将样品经溶解、过滤、洗涤后,在滤液中加入酚酞试液,再逐滴加入10%的稀盐酸直到溶液褪色,共消耗稀盐酸73克.则w(CaCO3)=______.
解:方案一,通过溶解、过滤、洗涤、烘干等操作后,所得固体为碳酸钙,即样品中碳酸钙的质量为10g;
50g样品中碳酸钙的质量分数=
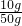
×100%=20%
故答案为:20%;
方案二,(1)设50g样品中碳酸钙的质量为x
CaCO
3~CO
2
100 44
x 11g
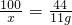
解之得 x=25g
50g样品中碳酸钙的质量分数=
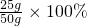
=50%
故答案为:50%;
(2)为减少误差,应把反应生成的二氧化碳全部收集,因此,最好使用气囊、气球或塑料袋进行收集(排水或排气不得分);
故答案为:气囊、气球或塑料袋;
方案三,设50g样品中含氢氧化钠的质量为y
NaOH~HCl
40 36.5
y 73g×10%
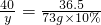
解之得 y=8g
50g样品中碳酸钙的质量分数=
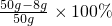
=84%
故答案为:84%.
分析:方案一:利用氢氧化钠易溶于水而碳酸钙不溶,通过溶解、过滤、洗涤、烘干等操作后除去样品中的氢氧化钠;碳酸钙质量与样品质量比即为样品中w(CaCO
3);
方案二:氢氧化钠、碳酸钙均可与盐酸反应,但氢氧化钠与盐酸反应生成氯化钠和水不产生气体二氧化碳;碳酸钙与盐酸反应放出气体二氧化碳,根据反应的化学方程式,由生成二氧化碳质量计算参加反应的碳酸钙质量;碳酸钙质量与样品质量比即为样品中w(CaCO
3);
此实验的目的是测定反应能产生二氧化碳的量,因此,不同于制取二氧化碳时的收集,应考虑把所产生的气体全部收集;
方案三:利用氢氧化钠易溶于水而碳酸钙不溶,通过溶解、过滤、洗涤后,所得滤液为氢氧化钠溶液;氢氧化钠溶液与稀盐酸反应生成氯化钠和水,反应后溶液呈中性,酚酞变成无色;根据反应的化学方程式,由盐酸的质量计算出样品中氢氧化钠质量,再利用质量差解得碳酸钙质量,碳酸钙质量与样品质量比即为样品中w(CaCO
3).
点评:实验室在制取气体时,为收集到较为纯净的气体,通常采取排水集气法和排空气法收集;而本题收集气体在于测定产生气体的质量,因此,实验室收集气体的方法在此不宜采用.

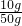 ×100%=20%
×100%=20%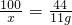 解之得 x=25g
解之得 x=25g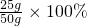 =50%
=50%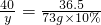 解之得 y=8g
解之得 y=8g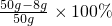 =84%
=84%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案