
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
分析 根据质量守恒定律和化学方程式为2R+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,反应前后原子个数不变,可以确定R的化学式的组成,进而比较各元素的质量多少,以及R的相对分子质量;来分析解答;
解答 解:
根据质量守恒定律和化学方程式为2R+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,生成物中为共含有4个碳原子、10个氧原子、4个氢原子,根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前物质中只有10个氧原子,则R中含有2个碳原子、2个氢原子,其化学式为:C2H2.则:
①根据分析,R的化学式为:C2H2,则R中一定含有碳、氢两种元素,无氧元素;
②根据分析,R的化学式为:C2H2,R中碳元素和氢元素的质量比是(12×2):(1×2)=12:1;
③根据2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,则可知:反应前后,由于有单质参加反应,而碳元素的化合价发生改变;
④根据分析,R的化学式为:C2H2,则R的相对分子质量等于12×2+1×2=26.
故选D.
点评 本题要求掌握并理解各元素的相对原子质量的作用;求物质中各元素的比值,计算某分子的相对分子质量,求某物质中某元素的质量分数都是基本的计算.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:解答题
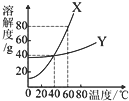 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
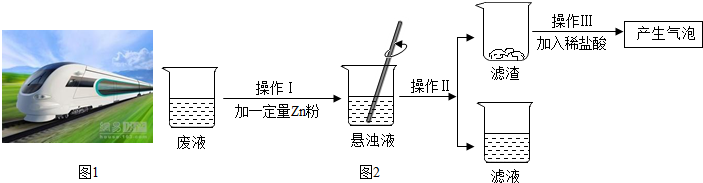
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaNO3 | B. | K2SO4 | C. | CO(NH2)2 | D. | Ca(H2PO4)和CaSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | NaOH溶液(Na2CO3) | 加入适量的Ca(OH)2溶液、过滤 |
| B | Fe(Cu) | 加足量稀硫酸后过滤 |
| C | CO(CO2) | 通过足量的NaOH溶液、干燥 |
| D | FeSO4溶液(H2SO4) | 加入足量Fe粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验操作 | 预期现象 | 结论 |
| 步骤1: 取少量原固体样品于试管中,逐渐加水并不断搅拌至烧杯内固体不再溶解 | 有白色固体 | 假设1成立 |
| 步骤2: 向步骤1反应后的白色固体中滴加足量稀稀HNO3溶液,并不断震荡 | 白色固体完全溶解,有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 定时间 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com