已知氢化钾能与水发生如下反应:KH+H2O=KOH+H2↑.现准确称取20g氢化钾放入230.5g水中,充分反应后,向所得的溶液中逐滴加入溶质质量分数为15%的硫酸镁溶液,至恰好完全反应,不再产生沉淀为止.计算下列各问题:
(1)在氢化钾与水反应中所产生的氢气的质量是多少克?
(2)反应中所加入硫酸镁溶液的质量是多少克?
(3)最终所得溶液中溶质的质量分数是多少?
(1)解:设产生H
2的质量为x,生成KOH的质量为y.
由化学反应方程式:
KH+H
2O=KOH+H
2↑
40 56 2
20 y x
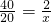
x=1 g
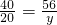
y=28 g
(2)解:设所加硫酸镁溶液的质量为m,生成的硫酸钾和氢氧化镁的质量分别为n和w.由反应方程式:
2KOH+MgSO
4=K
2SO
4+Mg(OH)
2↓
112 120 174 58
28 m×15% n w

m=200 g
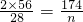
n=43.5 g
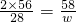
w=14.5 g
(3)
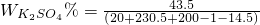
×100%=10%
答:产生氢气1 g,所加硫酸镁溶液为200 g,所得溶液中溶质质量分数为10%.
分析:(1)根据已知量20g氢化钾利用方程式KH+H
2O=KOH+H
2↑求出氢气和氢氧化钾;
(2)根据上题求出氢氧化钾利用方程式2KOH+MgSO
4=K
2SO
4+Mg(OH)
2↓求出相应的数据;
(3)根据上题求出的溶质比上溶液的总质量即可求出;
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

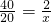
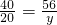

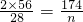
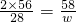
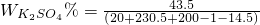 ×100%=10%
×100%=10% 

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案