
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
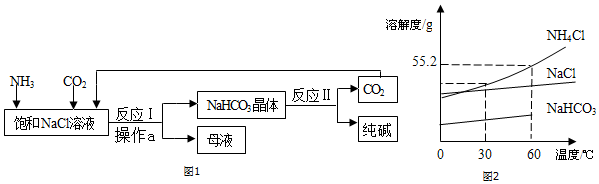
 “侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.
“侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | |
| 溶解度 (g/100g水) | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com