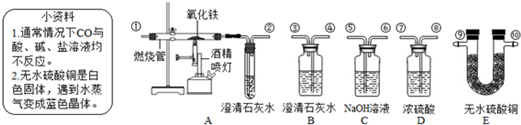
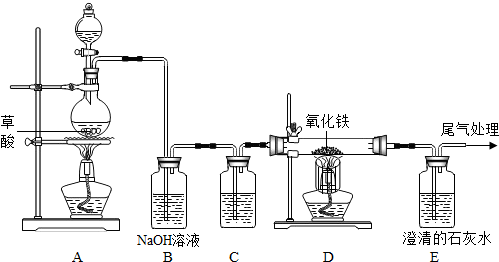
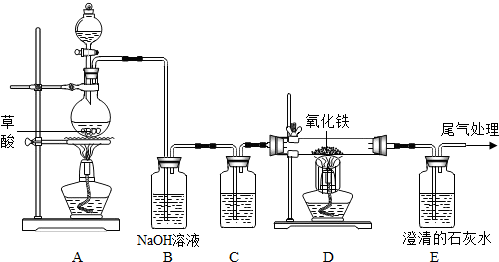
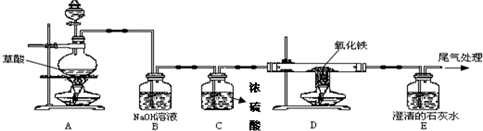
解:(1)根据该题的实验目的以及一氧化碳和二氧化碳的性质,可以判断先分离出一氧化碳,再分离出二氧化碳,就需要先将二氧化碳吸收,在实验室吸收二氧化碳常采用氢氧化钠溶液,方程式为2NaOH+CO
2═Na
2CO
3+H
2O,而干燥气体要用浓硫酸;
(2)氢氧化钠吸收了二氧化碳,生成碳酸钠,分离出了一氧化碳,要将二氧化碳分离出,又不能引入新的杂质,只能用稀硫酸,方程式为:H
2SO
4+Na
2CO
3=Na
2SO
4+H
2O+CO
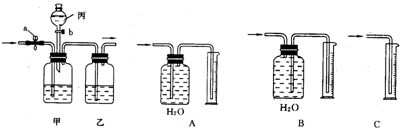
2↑,操作时关闭a,防止气体从a逸出,打开b,让丙中溶液缓缓流下至不再产生气泡时关闭b,使稀硫酸与碳酸钠充分反应;
(3)一氧化碳的密度比空气小且难溶于水,所以采用B装置测定一氧化碳的体积;
(4)解:设理论上可生成Cu的质量是x.
CO+CuO

Cu+CO
2
28 64
1.232L×1.25g/L x
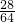
=

x=3.52g
答:理论上可生成Cu的质量是3.52g.
故答案为:(1)NaOH溶液;2NaOH+CO
2═Na
2CO
3+H
2O;稀H
2SO
4;
(2)关闭活塞a,打开活塞b,让丙中溶液缓缓流下至不再产生气泡时关闭b;H
2SO
4+Na
2CO
3═Na
2SO
4+H
2O+CO
2↑;
(3)B;
(4)3.52g.
分析:(1)根据实验室常用吸收二氧化碳,干燥气体的试剂进行分析解答;
(2)根据甲乙分离出气体的先后顺序(先一氧化碳后二氧化碳)和需要分离气体的性质进行分析;
(3)根据一氧化碳密度比空气小和难溶于水等物理性质进行分析解答;
(4)根据CO还原CuO的化学方程式进行解答.
点评:本题主要考查了利用化学方法对一氧化碳和二氧化碳的分离及根据化学方程式的计算,综合性强,需要较强的分析能力,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.

 CO2↑+CO↑+H2O.现用下图甲、乙装置(图中a、b为活塞的开关)对生成的CO和CO2进行分离并干燥.可供选用的试剂有稀硫酸、浓硫酸和氢氧化钠溶液.
CO2↑+CO↑+H2O.现用下图甲、乙装置(图中a、b为活塞的开关)对生成的CO和CO2进行分离并干燥.可供选用的试剂有稀硫酸、浓硫酸和氢氧化钠溶液.
 Cu+CO2
Cu+CO2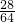 =
=