
(6分) 有资料表明,氧化铜代替二氧化锰加入氯酸钾中也能很快产生氧气.先将2.4g氧化铜与wg氯酸钾的混合物充分加热,使其不再产生气体后,残余固体经冷却、称量,质量为wg.然后将固体溶于21.3g水中,充分搅拌,过滤,得到滤液和黑色的滤渣.滤渣又经洗涤、烘干、称量,质量为2.4g。(注:不考虑每步实验过程中物质的损失;计算结果保留1位小数)
(1)该反应中氧化铜起 作用。
(2)求生成的O2质量;
(3)求所得的滤液溶质的质量分数.
(1)催化 (2)2.4g (3)14.9%
解析试题分析:(1)因为因为氧化铜代替二氧化锰加入氯酸钾中也能很快产生氧气,并且反应前后的质量不变,故该反应中氧化铜起催化作用
(2)根据质量守恒定律,生成的O2质量=2.4g+Wg-Wg=2.4g
(3)根据化学反应:2KClO3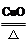 2KCl+3O2↑中与O2的KCl质量关系,先求出KCl质量,再来计算所得的滤液溶质的质量分数
2KCl+3O2↑中与O2的KCl质量关系,先求出KCl质量,再来计算所得的滤液溶质的质量分数
解:设KCl质量为x
2KClO3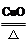 2KCl+3O2↑
2KCl+3O2↑
96
X 2.4g
149:96=x:2.4g
X=3.725g
所以所得的滤液溶质的质量分数=3.725g/(3.725g+21.3g)×100%=14.9%
考点:催化作用,质量守恒定律的应用,根据化学方程式计算


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:单选题
(6分)某含有杂质的CaCO3固体(杂质不溶于水,也不与酸反应),老师安排同学做测定该固体混合物中CaCO3质量分数的实验.利用电子天平测定的有关实验数据如下表:
| 称量项目 | 质量/g |
| 杂质和 CaCO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸(适量) | 141.20 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后55秒) | 149.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
煅烧石灰石可制得氧化钙(假设石灰石中的杂质不参与反应,且不含钙、碳元素).测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3.则已分解的碳酸钙占原碳酸钙的质量分数为( )
| A.40% | B.60% | C.30% | D.50% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
钙是维持人体正常功能所必需的元素。钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g。取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应)。烧杯内物质质量变为11.34g。试计算:
(1)反应产生二氧化碳 g,是 mol;
(2)每片钙尔奇中含碳酸钙 mol;
(3)服用钙尔奇通常一日2次,每次1片。则每人每天摄入钙元素的质量为 g。
(4)根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
| | 反应前 | 反应后 | |||
| 实验数据 | 烧杯的质量/g | 稀盐酸的质量/g | 混合物样品的质量/g | 烧杯和其中混合物的质量/g | |
| 40.6 | 123.4 | 12 | 171.6 | | |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图)。疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H20 2NaAl02+3H2↑。请回答下列有关问题:
(1)该管道疏通剂需要密封保存的原因是 。
(2)按照使用说明,该同学对“疏通剂”作了进一步研究。
先向烧杯中加人206g水,再加入本品200g,当铝粉
全部反应后,求:(计算结果保留1位小数)
①生成氢气的体积。(ρ氢气一0.09g/L)
②反应后溶液中氢氧化钠的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。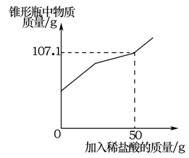
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用,电瓶内发生的化学反应是:
PbO2(固)+ 2H2SO4 + Pb = 2PbSO4↓+ 2H2O
某电瓶中装有36%的稀硫酸1200 g,电瓶工作时有310.5 g的铅参加反应。试计算:
(1)原稀硫酸中所含溶质的质量是 g。
(2)电瓶工作时消耗硫酸的质量。
(3)反应后硫酸溶液中溶质的质量分数。(最后结果精确到0.01%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
重铬酸钾(K2Cr2O7Mr=294,铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但+6价格有很强的毒性易污染环境,使用后,须用绿矾,(FeSO4?7H2O,Mr=278)将其变成毒性+3价格才能做后续处理.反应原理是:6FeSO4?7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com