C
分析:氢氧化钠固体变质是氢氧化钠与空气中的二氧化碳的反应,产物是碳酸钠和水,碳酸钠和氢氧化钠均能与硫酸反应生成硫酸钠,由化学反应中的元素守恒可知不管怎样变质,钠元素质量不变,所以生成的硫酸钠质量会相等,依据化学反应方程式的有关信息可对三种固体的消耗硫酸的量进行分析,要判断反应是否恰好进行可通过反应的现象及指示剂完成.
解答:A、氢氧化钠固体变质是氢氧化钠与空气中的二氧化碳的反应,其反应的方程式是:2NaOH+CO
2=Na
2CO
3+H
2O即每80份的氢氧化钠可生成106份的碳酸钠,所以变质越多质量越大,故三份固体的质量由小到大的顺序为:A<B<C;
B、硫酸与氢氧化钠反应无现象,借助酚酞遇碱变红的事实,可先在氢氧化钠中滴加酚酞,变红后滴加硫酸,只要红色恰好消失则证明氢氧化钠恰好反应,含有碳酸钠的氢氧化钠加入硫酸后会优先于氢氧化钠反应,而碳酸钠与硫酸反应会生成二氧化碳,所以B、C滴加稀硫酸直到正好不冒气泡时即是恰好反应.
C、从①2NaOH+H
2SO
4═Na
2SO
4+2H
2O,②2NaOH+CO
2=Na
2CO
3+H
2O③Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑,每两个氢氧化钠与硫酸反应消耗一个硫酸,每两个氢氧化钠转化成碳酸钠时会生成一个碳酸钠,而每个碳酸钠与硫酸反应时消耗一个硫酸,所以变质与否硫酸的消耗量不变,即:消耗稀硫酸的质量三固体相等.
D、对①CO
2+2NaOH=Na
2CO
3+H
2O,②Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑两个方程式综合(两边相加),可得:2NaOH+H
2SO
4=Na
2SO
4+2H
2O所以氢氧化钠变质与否不影响硫酸钠的生成,即生成的硫酸钠质量相等,设生成硫酸钠的质量为x
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 142
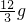
x
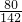
=
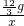
x=7.1g
故选C.
点评:本题考查了氢氧化钠的有关的性质,氢氧化钠的变质及相关计算,完成此题,可以依据已有的知识及化学方程式的有关计算进行.

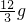 x
x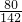 =
=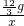


 阅读快车系列答案
阅读快车系列答案