将16g CuO粉末加入到200g一定质量分数的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液中加入W g铁粉,充分反应后过滤,将滤渣小心干燥后得固体物质为W g.
求:
(1)所加稀硫酸中溶质的质量分数.
(2)当W取何值时,才能满足加入铁粉和得到固体质量相等.
解:铁与硫酸铜反应生成铜,铁的相对原子质量为56,而铜为64,故应是固体质量增加,根据加入W g铁粉,与硫酸铜反应后得到固体物质为Wg可知,铁粉没有完全反应,硫酸铜完全反应,生成的W g固体物质是铜的质量,16g CuO粉末与稀硫酸完全反应,设需要硫酸的质量为x
CuO+H
2SO
4═CuSO
4+H
2O
80 98
16g x
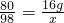
x=19.6g
W g铜完全来自氧化铜,根据元素守恒,则W=
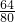
×100%×16g=12.8g
设生成12.8g铜需要铁的质量为y
Fe+CuSO
4=FeSO
4+Cu
56 64
y 12.8g
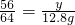
y=11.2g
则剩余铁的质量为:12.8g-11.2g=1.6g
设与1.6g铁反应需要硫酸的质量为z
Fe+H
2SO
4=FeSO
4+H
2↑
56 98
1.6g z
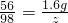
z=2.8g
故参加反应的硫酸的质量=19.6g+2.8g=22.4g
故硫酸的质量分数=
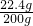
×100%=11.2%
由以上计算可知,只有当W取值为12.8g时,才能满足加入铁粉和得到固体质量相等.
答:(1)所加稀硫酸中溶质的质量分数为11.2%.(2)当W取值为12.8g时,才能满足加入铁粉和得到固体质量相等的要求.
分析:因为铁与硫酸铜反应生成铜,固体质量增加,根据加入W g铁粉,与硫酸铜反应后得到固体物质为Wg可知,铁粉没有完全反应,剩余的铁粉与稀硫酸反应,最后得到的W g固体物质为铜的质量,根据W g铜完全来自氧化铜,故可以计算出W的值.
点评:本题解题的关键是判断出有一部分铁粉与稀硫酸反应,最后得到的固体全部是铜的质量.

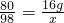
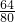 ×100%×16g=12.8g
×100%×16g=12.8g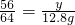
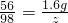
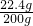 ×100%=11.2%
×100%=11.2%

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案