
现有Cu和CuO的固体混合物20g,为了分析混合物中Cu和CuO的含量,小
冰同学利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究。
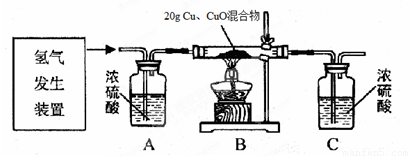
得到如下数据:(假定每步均完全反应或吸收)
|
装置 |
B |
C |
|
反应前质量 |
85.3g |
284.2g |
|
反应后质量 |
82.1g |
287.8g |
根据实验设计及有关数据进行分析与计算:
(1)生成水的质量是 g。
(2)混合物中CuO的质量分数是为多少?(写出计算过程)
(3)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________(不用化简);若玻璃管中的氧化铜没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。
(1)(1分)3.6
(2)(4分)(设答共1分,其它共3分)
解:设混合物中CuO的质量为X
H2+CuO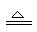 Cu+H2O
Cu+H2O
80 18
X 3.6g
80:18= X:3.6g
解得 X=16 g
混合物中氧化铀的质量分数为了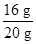 ×100%=80%
×100%=80%
答:混合物中氧化铜的质量分数是80%
(3)(2分)H:O=[(287.8—284.2)—(85.3-82.1)]:(85.3-82.1)
【解析】
试题分析:(1)在图示装置中,A的作用是除去氢气中的水蒸气;B的作用是反应装置;C的作用是吸收生成的水。所以生成水的质量实际上就是C装置的质量变化值。即287.8g—284.2g=3.6g
(2)已知:水的质量 未知:氧化铜在混合物中的质量分数。 解题思路:可根据水和氧化铜在反应中的质量关系求出氧化铜的质量,再求出其质量分数。具体解题过程见答案
(3)装置B内的物质在反应前为氧化铜,反应后为铜。所以反应前后的质量差值即为氧元素的质量。即(85.3-82.1)g。水中氢元素的质量为:[(287.8—284.2)—(85.3-82.1)]g。
考点:科学探究、根据化学方程式的计算


 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
| 第 次 | 加入稀盐酸的体积/mL | 剩余固体的质量/g |
| 1 | 40 | 16 |
| 2 | 40 | 12 |
| 3 | 40 | 8 |
| 4 | 40 | 8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 小王 | 小丽 | 小江 | 小兵 | |
| 所取固体样品的质量/克 | 30 | 25 | 20 | 20 |
| 加入硫酸溶的质量/克 | 100 | 100 | 100 | 120 |
| 后应后剩余固体的质量/克 | 22 | 17 | 12 | 12 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:新教材完全解读 九年级化学 (上册) 人教版 人教版 题型:038
现有Cu和CuO的混合物10 g,用H2完全还原后得到金属Cu的质量为8.4 g,求原混合物中CuO的质量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com