
 在一烧杯中盛有一定质量的MgCO3固体,向其中滴加溶质的质量分数为10%的H2SO4溶液,至恰好完全反应.得到102g不饱和溶液.向所得溶液中逐滴滴人溶质质量分数为l0%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
在一烧杯中盛有一定质量的MgCO3固体,向其中滴加溶质的质量分数为10%的H2SO4溶液,至恰好完全反应.得到102g不饱和溶液.向所得溶液中逐滴滴人溶质质量分数为l0%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题: ,
,

 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源:2008年山东省济南市初中毕业升学统一考试、化学试卷 题型:043
在一烧杯中盛有一定质量的MgCO3固体,向其中滴加溶质的质精分数为10%的H2SO4溶液,至恰好完全反应.得到102 g不饱和溶液.向所得溶液中逐滴滴人溶质质量分数为l0%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
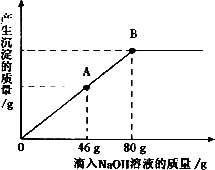
(1)在滴入稀硫酸时,观察到的明显实验现象是________.
(2)当滴入NaOH溶液至图中A点时,烧杯中溶液里含有的溶质是(写化学式)________.
(3)当滴入10%的NaOH溶液80 g时(即B点),试通过计算,求此时所得小饱和溶液的质量.(计算结果精确至0.1 g)
查看答案和解析>>
科目:初中化学 来源:山东省中考真题 题型:计算题
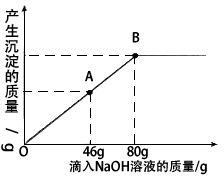
查看答案和解析>>
科目:初中化学 来源: 题型:
在一烧杯中盛有一定质量的MgCO3固体,向其中滴加溶质的质精分数为10%的H2SO4溶液,至恰好完全反应。得到102g不饱和溶液。向所得溶液中逐滴滴人溶质质量分数为l0%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液的质量关系曲线如图所示。请根据题意回答下列问题:
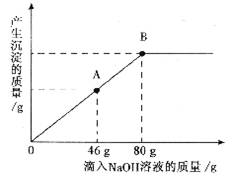
(1)在滴入稀硫酸时,观察到的明显实验现象是______________________________。
(2)当滴入NaOH溶液至图中A点时,烧杯中溶液里含有的溶质是(写化学式) ____________________________________________________________________________。
(3)当滴入10%的NaOH溶液80g时(即B点),试通过计算,求此时所得小饱和溶液的质量。(计算结果精确至0.1g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com