C
分析:根据镁可与硫酸反应生成氢气,并据生成氢气的质量计算生锈的镁带中镁的质量,进而计算出氧化镁的质量,得出样品中镁元素的总质量,据质量分数计算出样品中镁元素的质量分数.
解答:设样品中镁的质量是x
Mg+H
2SO
4═MgSO
4+H
2↑
24 2
x 0.1g
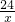
=

x=1.2g
MgO质量=3.2g-1.2g=2g,其中含Mg:2g×

×100%=1.2g;
Mg的总质量=1.2g+1.2g=2.4g,该样品中镁元素的质量分数为

×100%=75%.
故选C.
点评:本题考查了学生依据方程式进行计算的能力,并明确氢前金属可与酸反应生成氢气,以及混合物中元素质量分数的计算方法是解答此题的关键.
