
某学生做了如下图所示的实验。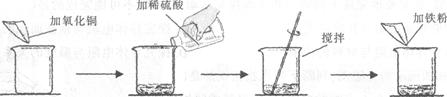
| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
(1)CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu;
(2)Cu0、Cu、Fe;
(3)56/64 =5.6g/X
(4)8g
(5)7.6%;
(6)80g
解析试题分析:(1)氧化铜与硫酸反应生成硫酸铜和水:CuO+H2SO4=CuSO4+H2O
铁和硫酸铜发生置换反应生成铜和硫酸亚铁:Fe+CuSO4=FeSO4+Cu;
(2)根据表格可知:第二次加入酸的质量为100g时,氧化铜完全反应,铁也是完全反应。那么第一次加入的硫酸不足,即氧化铜没有反应掉,那么铁粉过量,故第一次实验后的固体物质有氧化铜、铜、铁;
(3)第二次实验生成的固体物质是铜,利用化学方程式,根据铁的质量可求出铜的质量。
设生成铜的质量为x;
Fe+CuSO4=FeSO4+Cu
56 64
5.6g X
56/64 =5.6g/X
X=6.4g
(4)利用质量守恒定律化学反应前后元素的质量不变,反应后生成铜的质量为6.4g,设氧化铜的质量为y,则:y× 64/80 ×100% =6.4g
y=8g
(5)设生成的硫酸亚铁的质量为Z,
Fe+CuSO4=FeSO4+Cu
5.6 152
5.6g z
56/152 =5.6g/z
Z=15.2g
反应后溶液的质量=8g+100g+5.6g+92.8g-6.4g=200g
溶质的质量分数=15.2g/200g ×100%=7.6%
(6)设加入的硫酸中溶质的质量为a,
CuO+H2SO4=CuSO4+H2O
80 98
8g a
80/98 =8g/a
a=9.8g
根据溶液稀释前后溶质的质量不变,假设稀释后溶液的质量为b,
49%b=9.8g
b=20g
那么加水的质量=100g-20g=80g
考点:利用化学方程式的计算


科目:初中化学 来源: 题型:计算题
实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。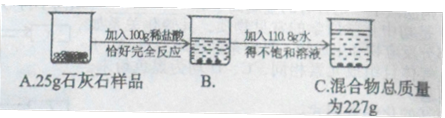
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将6.8 g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算
⑴生成氢气的质量 。
⑵锌粒中所含锌的质量分数(精确到0.1%)。(Zn-65 H-1)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)在铁路建设中常利用铝热反应焊接钢轨,反应的化学方程式为:
Fe2O3 + 2Al ="====" Al2O3 + 2Fe ;若将两段钢轨焊接需要224g的铁,需在反应中加入原料氧化铁的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| | 反应前 | 反应后 | |
| 实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
| 130 g | 40 g | 167.13 g | |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量分数。取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,得到了如图所示的曲线关系。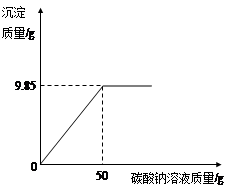
技术员给小红的提示:
①反应的化学方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl
②水的密度:1g/cm3
求产品中氯化钠的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
下面是工厂苛化法生产烧碱的示意图。
(1)在实验室,操作Ⅰ的名称是 ;经操作Ⅰ得到废渣的主要成份是 (写化学式)。
(2)物质X中各元素的质量比表示为 。
(3)某工厂化验员向含有1.6 g氢氧化钠的溶液中,逐滴加入20.0 g盐酸至氢氧化钠和盐酸恰好完全反应。求盐酸中溶质的质量分数为多少?(写出过程)
(4)若用1.6 g上述得到的固体烧碱产品(含杂质)代替1.6 g氢氧化钠,逐滴加入上述相同浓度盐酸至反应物恰好完全反应,则消耗盐酸的质量 20 g(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。试计算:
(1)用10克30%的浓盐酸配制成2%的稀盐酸,需加水多少克?
(2)取20克废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3克,求废水中氢氧化钾的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
晶体硅(Si)是一种重要的半导体材料.冶炼硅时常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式是:
SiO2+2C  Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com