
| A. | CO(CO2)-通过灼热的CuO粉末 | |
| B. | NaCl(Na2SO4)-加入适量的Ba(NO3)2溶液 | |
| C. | CaO固体(CaCO3固体)-加足量水后过滤 | |
| D. | FeSO4溶液(H2SO4)-加入适量铁粉 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、CO能与灼热的CuO粉末反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、Na2SO4能与适量的Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误.
C、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、H2SO4能与适量铁粉反应生成硫酸亚铁溶液和氢气,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
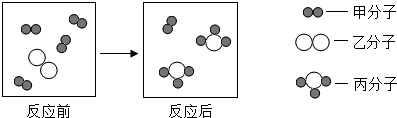
| A. | 参加反应的甲和乙分子个数比为4:1 | |
| B. | 该反应属于置换反应 | |
| C. | 反应前后原子的种类、数目都不变 | |
| D. | 反应前后各种元素的化合价都不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
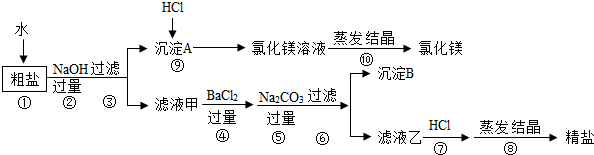
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 图书馆内图书着火,立即用高压水枪来灭火 | |
| B. | 将粉末状煤做成蜂窝煤,目的是增大煤与空气的接触面积,使燃烧更充分 | |
| C. | 用扇子扇煤炉火焰,越扇越旺,是因为提供了更充足的氧气 | |
| D. | 菜锅里的油着火时可以用锅盖盖灭,因为隔绝了空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可用点燃的方法检验天然气是否泄漏 | |
| B. | 回收废弃的塑料可以减少“白色污染” | |
| C. | 食用甲醛水溶液浸泡过的海产品对人体无害 | |
| D. | 在香肠中添加过量的亚硝酸钠保持肉质鲜美 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象和结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管中 | 多余空 |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 有气泡产生,品红溶液褪色,证明含有Na2SO3 |
3 | 向B试管中,加入足量的氯化钡溶液溶液,再加入足量的稀盐酸 | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有Na2SO4,则猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com