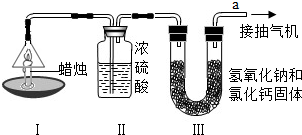
解:(1)把二氧化碳通入氢氧化钠溶液中,二氧化碳与氢氧化钠溶液反应生成碳酸钠,当所有的氢氧化钠都转化为碳酸钠后,若继续通入二氧化碳,则新通入的二氧化碳又与刚刚生成的碳酸钠反应生成碳酸氢钠.
所以得到的白色固体有三种可能:通入少量气体时得到的白色固体是生成的碳酸钠和剩余的氢氧化钠;当氢氧化钠反应完后,继续通气体、此时得到的白色固体是碳酸钠和碳酸氢钠;若此后继续通气体,则得到的白色固体是碳酸氢钠.
(2)取一定质量的样品,加热时固体质量减少,根据2NaHCO
3
Na
2CO
3+CO
2↑+H
2O而Na
2CO
3和NaOH的热稳定性都较好的资料信息,可判断白色固体中一定含有受热可以分解的NaHCO
3;由于NaHCO
3+NaOH=Na
2CO
3+H
2O反应的存在,因此NaHCO
3与NaOH不能同时存在,所以白色固体中一定没有NaOH;另取样品,向其中滴加稀盐酸,有气体产生,再次利用资料信息:Na
2CO
3+HCl=NaHCO
3+NaCl,NaHCO
3+HCl=NaCl+H
2O+CO
2↑,可判断白色固体中可能含有Na
2CO
3;
故答案为:
(1)Na
2CO
3和NaHCO
3;NaHCO
3;
(2)一定有NaHCO
3;一定没有NaOH;可能有Na
2CO
3分析:(1)把二氧化碳逐渐通入氢氧化钠溶液中反应的原理是:二氧化碳与氢氧化钠反应生成碳酸钠,当所有的氢氧化钠都转化为碳酸钠后,新通进的二氧化碳又与刚刚生成的碳酸钠反应生成碳酸氢钠.
(2)根据实验操作及对应的实验现象,结合[资料卡]中的相关反应信息,完成对白色固体的成分的可能性判断.
点评:探究类问题中所给出的资料信息,对于探究类问题的解决往往会起到关键性作用,本题的解答就是一个典型的例子,反应使用资料信息进行分析与判断.

 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O; Na2CO3+CO2↑+H2O而Na2CO3和NaOH的热稳定性都较好的资料信息,可判断白色固体中一定含有受热可以分解的NaHCO3;由于NaHCO3+NaOH=Na2CO3+H2O反应的存在,因此NaHCO3与NaOH不能同时存在,所以白色固体中一定没有NaOH;另取样品,向其中滴加稀盐酸,有气体产生,再次利用资料信息:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,可判断白色固体中可能含有Na2CO3;
Na2CO3+CO2↑+H2O而Na2CO3和NaOH的热稳定性都较好的资料信息,可判断白色固体中一定含有受热可以分解的NaHCO3;由于NaHCO3+NaOH=Na2CO3+H2O反应的存在,因此NaHCO3与NaOH不能同时存在,所以白色固体中一定没有NaOH;另取样品,向其中滴加稀盐酸,有气体产生,再次利用资料信息:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,可判断白色固体中可能含有Na2CO3;


 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
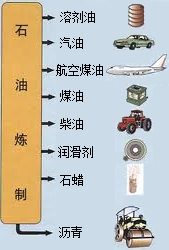 中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).
中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).