生活无处不化学,请同学们用学过的化学知识来解决生活中的问题:
(1)在稀硫酸、熟石灰、食盐、纯碱、硫酸铜、硝酸钾中选择合适的物质,将其化学式填入下列空格中:可检验酒精中是否含有水的是 ;可用做复合肥的是 ;可用于除去金属表面氧化物的是 ;可做食品调味剂的是 ;可做建筑材料的是 ;可做厨房洗涤剂的是 .
(2)溶液的酸碱度常用 来表示,它的范围在 之间,测定它的最简便方法是用 ;某土壤的PH为5,这种土壤显 性,农业上常用 来改良酸性土壤.
(3)有少量氢氧化钠溶液的试管中,滴入几滴酚酞试液,溶液呈 色,再慢慢地加入稀盐酸,并不断振荡至溶液刚好呈无色时,溶液显 性,此反应化学方程式是 ,它属于 (填基本反应类型).
(4)为除去铁钉上的锈迹,某学生将带铁锈的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈 色.这是因为(用化学方程式表示) ,不一会儿,又看到铁钉表面有 产生,这是因为(用化学方程式表示) .
【答案】分析:(1)根据物质的性质决定用途分析
(2)根据溶液酸碱度的测量方法及酸碱度与酸碱性的关系分析
(3)根据盐酸与氢氧化钠发生中和反应的过程分析
(4)根据盐酸的化学性质分析
解答:解:(1)白色硫酸铜粉末与水能变蓝,因此可检验酒精中是否含有水;硝酸钾中含有氮元素和钾元素,属于复合肥;硫酸能与金属氧化物反应,可用于除去金属表面氧化物;氯化钠可做食品调味剂;石灰浆可用来抹墙,可做建筑材料;碳酸钠溶液呈碱性,可除油污,故可做厨房洗涤剂,根据化合价及书写化学式的原则分别写出它们的化学式为
(1)CuSO4; KNO3; H2SO4; NaCl; Ca(OH)2; Na2CO3
(2)溶液的酸碱度常用 pH来表示,它的范围在 0~14之间,测定它的最简便方法是用 pH试纸;PH小于7呈酸性,故pH为5的这种土壤显 酸性,农业上常用 熟石灰来改良酸性土壤.
(3)氢氧化钠溶液能使酚酞试液变 红色,氢氧化钠与盐酸反应,碱性慢慢减弱,当恰好完全反应时溶液为氯化钠溶液,呈中性,此反应化学方程式是 NaOH+HCl═NaCl+H2O,该反应是两种化合物交换成分生成另外两种化合物的反应,属于 复分解反应
(4)盐酸与氧化铁反应生成氯化铁和水,氯化铁溶液为黄色,化学方程式为 Fe2O3+6HCl═2FeCl3+3H2O当铁锈完全反应后盐酸继续与铁反应生成氢气,因此看到有气泡生成,化学方程式为 Fe+2HCl═FeCl2+H2↑
故答案为:(1)CuSO4; KNO3; H2SO4; NaCl; Ca(OH)2; Na2CO3.
(2)pH 0~14 pH试纸; 酸 熟石灰.
(3)红 中 NaOH+HCl═NaCl+H2O,复分解反应
(4)黄 Fe2O3+6HCl═2FeCl3+3H2O,气泡 Fe+2HCl═FeCl2+H2↑
点评:本题考查酸碱盐中的基础知识,应熟练掌握.



 53随堂测系列答案
53随堂测系列答案 “嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.
“嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.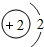 D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子