
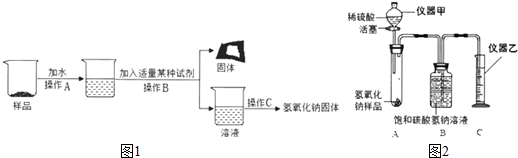
分析 ①根据氢氧化钠变质是与二氧化碳反应生成碳酸钠和水解答;根据碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙和氢氧化钠,其中碳酸钙为固体解答;
②根据氢氧化钠变质是与二氧化碳反应生成碳酸钠和水,最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量解答;
③根据要测定该固体中NaOH的纯度,需要称量解答;
④根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析,
⑤根据装置内最终有残留的二氧化碳无法排尽,二氧化碳体积变小,所求碳酸钠质量变小,氢氧化钠固体质量变大解答;
⑥根据中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大解答.
解答 解:
①氢氧化钠变质是与二氧化碳反应生成碳酸钠和水,长期暴露在空气中的氢氧化钠固体样品,所含杂质是Na2CO3;操作B的名称为过滤,
碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙和氢氧化钠,该反应的化学方程式是Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
②根据反应看出,变质生成的碳酸钠通过反应生成氢氧化钠,最终所得氢氧化钠固体质量比变质后样品中氢氧化钠的质量多.
③若要测定该固体中NaOH的纯度,实验过程中一定还需用到的仪器是托盘天平;
④本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳的减少.
⑤装置内最终有残留的二氧化碳无法排尽,二氧化碳体积变小,所求碳酸钠质量变小,氢氧化钠固体质量变大,测定的NaOH纯度将偏大;
⑥中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大,会造成测定的NaOH纯度将偏小.
答案:
①Na2CO3;过滤; Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
②大于;
③托盘天平;
④CO2能溶于水,造成误差增大;
⑤偏大;
⑥偏小; 中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大.
点评 熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.


科目:初中化学 来源: 题型:解答题
 学习酸碱中和反应时,甲乙两同学对其产生探究兴趣.
学习酸碱中和反应时,甲乙两同学对其产生探究兴趣.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲状腺肿大可能是缺铁所致 | |
| B. | 霉变的花生米洗净后仍可正常食用 | |
| C. | 可用结晶的方法提纯混有少量氯化钠的硝酸钾 | |
| D. | 铅、金、钛属于金属元素,硫、氮、汞属于非金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
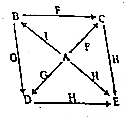 A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).
A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com