
一种表面被氧化成三价金属氧化物的金属样品,据测定,在该氧化物中,金属元素与氧元素的质量比是
9∶8,取样品12.9g,投入300g稀盐酸中,待样品完全溶解后,收集到0.3g氢气.在反应后的溶液中,加入10%的NaOH溶液40g,恰好将溶液中剩余的盐酸中和.求:(1)通过计算,确定该金属的相对原子质量,又知该金属的原子核内有14个中子,确定该金属为何种元素?
(2)样品中,此金属的质量分数.
(3)所用盐酸溶质的质量分数.
 53天天练系列答案
53天天练系列答案科目:初中化学 来源: 题型:解答题

| 种类 | 优点 | 缺点 |
| 示例:铜锅 | 导热性能好 | 成本高,铜锈对人体有害 |
| 铁锅 | ______ | ______ |
| 铝锅 | ______ | ______ |

查看答案和解析>>
科目:初中化学 来源: 题型:
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料。已知不同价态的铁元素之间能相互转化,转化关系如下图1所示:
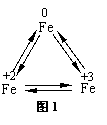 |
(1)写出工业上以赤铁矿(主要成分为Fe2O3)为原料炼铁的化学方程式 ,这个反应实现了 的转化。
(2)FeCl2易被空气中的氧气氧化成FeCl3。所以在配制FeCl2溶液时,常常向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2。请根据上述信息写出FeCl3重新转化为FeCl2的化学方程式__________ 。
(3)图2表示的是一种医疗上用来治疗贫血的药品—硫酸亚铁片的说明书。
 |
计算FeSO4·7H2O的相对分子质量_________。药片表面的糖衣可以起到________作用。
(4)FeCl3能腐蚀铜,工业上常用此原理制作印刷线路板。图3是印刷线路板的制作及废液的处理过程:

其中滤渣的成分有__________,步骤③中发生反应的化学方程式有_______________ _;该流程中可以回收利用的物质有__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com