
31.(4分)现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成。
【查阅资料】镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属化合物和氢气。
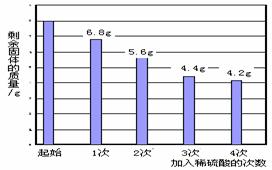
【实验步骤及数据】取该混合物粉末8.0 g放入烧杯中,将140.0 g 溶质的质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图:
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
(4分)
解:⑴混合物中Cu的质量分数=![]() …………………………1分
…………………………1分
⑵设M金属单质的相对原子质量为X,所得溶液中MgSO4的质量为y,生成H2的质量为z
M + H2SO4=== MSO4 + H2↑…………………………………………1分
X 98 2
8g-4.4g 105g×14% y z
X:98=3.6g:35g×14% X=24…………………………………………1分
该金属是镁。
98:120==105g×14%:y y=18g
98:2====105g×14%:z z=0.3g
MgSO4溶液的质量分数为18g/(105g+3.6g-0.3g) ×100%≈16.6%.........1分
答:该混合物粉末中铜的质量分数是52.5%;第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是16.6%.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:初中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 12.75 | 9.5 | 6.25 | 5.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 40.0 | 40.0 | 40.0 | 40.0 |
| 烧杯中剩余物质的质量/g | 59.88 | 99.76 | 139.64 | 179.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com