化学兴趣小组对某生铁样品中铁的质量分数进行探究.请按照要求完成实验过程(提示:假设生铁样品中的其它成分不与稀硫酸反应).
实验目的:________
实验过程:取一只烧杯,称得其质量为68.6g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为108.6g;向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入稀硫酸以确保过量,测得共用去稀硫酸217.6g;静置,称量.称得烧杯和剩余物质的总质量为325.2g.
数据处理:计算该生铁样品中铁单质的质量分数.
反思交流:实验过程中把生铁样品加工成碎屑的目的是________.
测定某生铁样品中单质铁的质量分数 让稀硫酸与铁屑接触更充分、反应速率更快、实验结果更精确
分析:实验目的:测定某生铁样品中单质铁的质量分数.
数据处理:烧杯中减少的质量是生成氢气的质量,根据铁与稀硫酸反应的化学方程式可以计算出样品中单质铁的质量.进而计算出样品中单质铁的质量分数.
反思交流:实验过程中把生铁样品加工成碎屑的目的是为了让稀硫酸与铁屑接触更充分、反应速率更快.
解答:实验目的:由化学兴趣小组对某生铁样品中铁的质量分数进行探究可知,实验目的是测定某生铁样品中单质铁的质量分数.
数据处理:生成氢气的质量为108.6g+217.6g-325.2g=1g
设样品中单质铁的质量为x.
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
x 1g
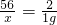
x=28g
样品中单质铁的质量分数为
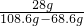
×100%=70%
答:该生铁样品中铁单质的质量分数70%.
反思交流:实验过程中把生铁样品加工成碎屑的目的是为了让稀硫酸与铁屑接触更充分、反应速率更快、实验结果更精确.
故答案为:实验目的:测定某生铁样品中单质铁的质量分数.
数据处理:70%.
反思交流:让稀硫酸与铁屑接触更充分、反应速率更快、实验结果更精确.
点评:本题主要考查探究生铁中铁的质量分数的方法和有关化学方程式的计算和化学式的计算,解答时要按步骤规范准确的解答.

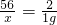
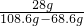 ×100%=70%
×100%=70%
