
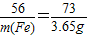
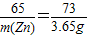
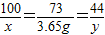
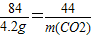
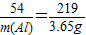
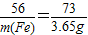


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| A、偏左 | B、偏右 | C、指向中间 | D、无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:
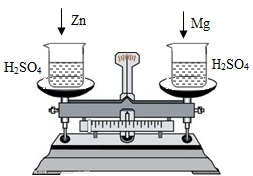 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )| A、仅① | B、仅② | C、①② | D、②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )
在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com