


科目:初中化学 来源: 题型:阅读理解

| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 我们都知道CO2与NaOH溶液是很容易反应的,利用下图装置可进行“喷泉”实验.按图l进行实验的步骤是:首先在圆底烧瓶中充满干燥的CO2气体,在胶头滴管中吸满NaOH溶液(注意:一般情况下不能如此便用胶头滴管),按图1连接好装置,并固定在铁架台上.然后打开止水夹,将胶头滴管中的NaOH溶液挤入烧瓶内.在导管的尖嘴处就会形成美丽的“喷泉”.
我们都知道CO2与NaOH溶液是很容易反应的,利用下图装置可进行“喷泉”实验.按图l进行实验的步骤是:首先在圆底烧瓶中充满干燥的CO2气体,在胶头滴管中吸满NaOH溶液(注意:一般情况下不能如此便用胶头滴管),按图1连接好装置,并固定在铁架台上.然后打开止水夹,将胶头滴管中的NaOH溶液挤入烧瓶内.在导管的尖嘴处就会形成美丽的“喷泉”.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能含SO42- 可能含SO42- |
取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
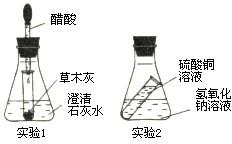 实验探究:下列实验1和实验2反应前后天平是否平衡?请回答问题:
实验探究:下列实验1和实验2反应前后天平是否平衡?请回答问题:| 实验编号 | 实验1 | 实验2 |
| 实验现象 | 小试管中有气泡产生,澄清石灰水变浑浊 小试管中有气泡产生,澄清石灰水变浑浊 |
有蓝色絮状沉淀生成 有蓝色絮状沉淀生成 |
化学方程式 |
K2CO3+2HAc=2KAc+H2O+CO2↑ Ca(OH)2+CO2=CaCO3↓+H2O K2CO3+2HAc=2KAc+H2O+CO2↑ Ca(OH)2+CO2=CaCO3↓+H2O |
CuSO4+2NaOH=Cu(OH)2+Na2SO4 CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
| 反应前后天平是否平衡 | 平衡 平衡 |
平衡 平衡 |
| 你的结论 | 化学反应前后,参加反应物质的总质量等于生成物质的总质量 化学反应前后,参加反应物质的总质量等于生成物质的总质量 |
化学反应前后,参加反应物质的总质量等于生成物质的总质量 化学反应前后,参加反应物质的总质量等于生成物质的总质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com