C
分析:根据酸发生置换反应的条件:(1)对金属的要求:必须是金属活动性顺序中排在氢以前的金属;(2)对酸的要求:这里所指的酸并不是所有的酸,主要是指稀盐酸和稀硫酸.
金属与酸反应产生H
2的规律:
(1)H
2的质量=金属的质量×

(2)等质量的几种金属与足量酸反应产生的H
2质量,该值越大,产生的H
2质量越多,该值越小,产生的H
2质量越小
解答:5.6克纯铁片放在足量的稀盐酸中 放出的氢气是0.2克,存在杂质导致生成的氢气的质量减少,即相同质量金属杂质比铁生成的氢气质量少或不产生氢气;
化学方程式

Zn+2HCl═ZnCl
2+H
2↑

Mg+2HCl═MgCl
2+H
2↑

Fe+2HCl═FeCl
2+H
2↑
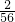
,
观察数值,所以相同质量的锌、镁、铁与足量的盐酸反应,生成氢气的质量大小为:镁>铁>锌;而银、铜不与盐酸反应;故锌、银、铜可能含有.
故选C.
点评:利用等质量的几种金属与足量酸反应产生的H
2质量与

的值成正比,该值越大,产生的H
2质量越多,该值越小,产生的H
2质量越小可知:相同质量的金属镁、铝、锌、铁与足量盐酸反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌





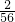 ,
, 的值成正比,该值越大,产生的H2质量越多,该值越小,产生的H2质量越小可知:相同质量的金属镁、铝、锌、铁与足量盐酸反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌
的值成正比,该值越大,产生的H2质量越多,该值越小,产生的H2质量越小可知:相同质量的金属镁、铝、锌、铁与足量盐酸反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌 
