
 自然界中人与动物的生存都离不开氧气.
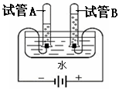
自然界中人与动物的生存都离不开氧气. 2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.
2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.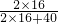 ×100%=3.2g
×100%=3.2g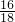 ×100%=32g
×100%=32g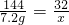
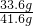 ×100%=80.8%
×100%=80.8%

 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:
 自然界中人与动物的生存都离不开氧气:
自然界中人与动物的生存都离不开氧气:查看答案和解析>>
科目:初中化学 来源: 题型:
 28、自然界中人与动物的生存都离不开氧气.
28、自然界中人与动物的生存都离不开氧气.查看答案和解析>>
科目:初中化学 来源: 题型:
 自然界中人与动物的生存都离不开氧气.
自然界中人与动物的生存都离不开氧气.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 自然界中人与动物的生存都离不开氧气:
自然界中人与动物的生存都离不开氧气:查看答案和解析>>
科目:初中化学 来源:2009年北京市宣武区中考化学一模试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com