把15g不纯硫酸钠(所含杂质不溶于水),放入85.8g水中配成溶液.过滤后,取10g溶液加入适量的氯化钡溶液,恰好完全反应,生成2.33g白色沉淀.试计算:(最后结果保留二位小数)
(1)10g溶液中硫酸钠的质量.
(2)原不纯硫酸钠中含硫酸钠的质量分数.
解:(1)设10 g溶液中硫酸钠的质量为x
Na
2SO
4+BaCl
2=BaSO
4↓+2NaCl
142 233
x 2.33 g
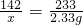
x=1.42g
(2)85.5 g水溶解的Na
2SO
4的质量为

×85.8=14.2g;原不纯硫酸钠中Na
2SO
4的质量分数为
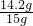
×100%=94.67%
分析:(1)根据题意分析知,硫酸钠和氯化钡反应生成白色沉淀硫酸钡的质量2.33g,然后根据硫酸钡的质量利用化学方程式Na
2SO
4+BaCl
2=BaSO
4↓+2NaCl求出硫酸钠的质量;
(2)根据1.42g硫酸钠溶解在10-1.42=8.58g水中,通过比例求出85.5 g水溶解的Na
2SO
4的质量,根据溶质的质量分数=

×100%原不纯硫酸钠中含硫酸钠的质量分数.
点评:本题主要考查有关化学方程式的计算,关键找出题中的已知量,根据已知量求出未知量,注意解题步骤.

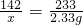
 ×85.8=14.2g;原不纯硫酸钠中Na2SO4的质量分数为
×85.8=14.2g;原不纯硫酸钠中Na2SO4的质量分数为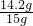 ×100%=94.67%
×100%=94.67% ×100%原不纯硫酸钠中含硫酸钠的质量分数.
×100%原不纯硫酸钠中含硫酸钠的质量分数.
