
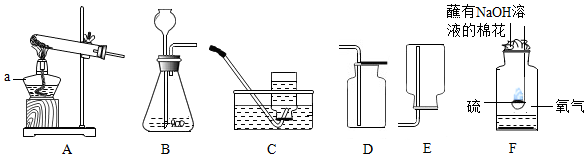
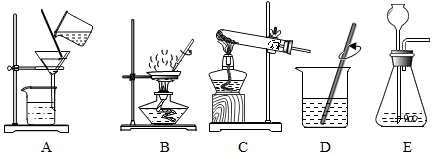
分析 Ⅰ.(1)a仪器的名称是酒精灯;
(2)氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气;
过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气能使带火星的木条复燃;
(3)二氧化硫能和氢氧化钠反应生成亚硫酸钠和水;
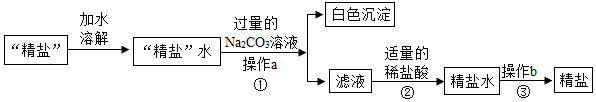
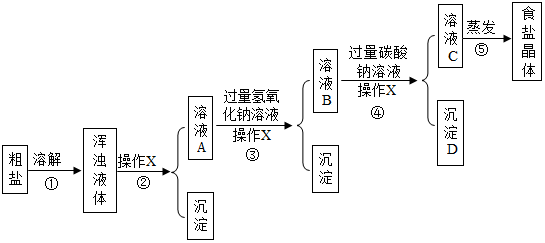
Ⅱ.(1)操作b的名称是蒸发;
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(3)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
(4)碳酸钠溶液显碱性,能使酚酞试液变红色;
(5)若不考虑损耗,经过上述处理得到的精盐质量大于原“精盐”质量,原因是反应过程中生成了氯化钠.
解答 解:Ⅰ.(1)a仪器的名称是酒精灯.
故填:酒精灯.
(2)如用装置A制取氧气时,由于试管口没有塞一团棉花,应该是利用氯酸钾制取氧气,氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
如用装置B制取氧气,往长颈漏斗中倒入的液体药品是过氧化氢溶液;
如用装置D收集氧气,则验满的方法是:把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
故填:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;过氧化氢溶液;把带火星的木条放在集气瓶口,如果带火星的木条复燃,说明已经收集满.
(3)小明用装置F做硫在氧气中燃烧的实验,该改进实验最大优点是能够吸收反应生成的二氧化硫,防止污染环境.
故填:能够吸收反应生成的二氧化硫,防止污染环境.
Ⅱ.(1)操作b的名称是蒸发.
故填:蒸发.
(2)步骤①加入过量的Na2CO3溶液的目的是除尽氯化钙.
故填:除尽氯化钙.
(3)步骤②中碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(4)证明经过步骤②后过量的Na2CO3已除尽的方法可以是:取少量反应后的溶液于试管中,滴加少量酚酞试液,如果没有变红色,则过量的Na2CO3已除尽.
故填:取少量反应后的溶液于试管中,滴加少量酚酞试液,如果没有变红色,则过量的Na2CO3已除尽.
(5)若不考虑损耗,经过上述处理得到的精盐质量大于原“精盐”质量,原因是:CaCl2与Na2CO3反应生成NaCl,且过量的Na2CO3与盐酸反应时也生成NaCl.
故填:大于;CaCl2与Na2CO3反应生成NaCl,且过量的Na2CO3与盐酸反应时也生成NaCl.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com