
| ʵ����� | ʵ������ | ʵ����� |
| �ٴӼ�ͬѧ���ձ���ȡ�����ϲ���Һ���Թ��У������еμ������� ����Һ�� | �а�ɫ�������� | ���ɰ�ɫ�����Ļ�ѧ����ʽΪ�� �� ���� |
| �ڹ��ˣ�����Һ�еμ���ɫ��̪��Һ�� | ���������� | ͨ��ʵ�鼰��������Ʒ�в����У� �� ���� |


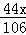
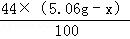
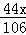 +
+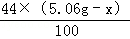 =2.2g
=2.2g


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
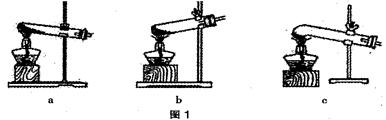
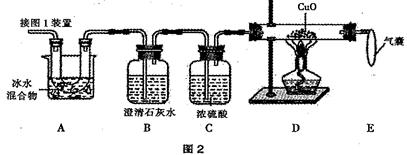
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| �۵� | �е� | ���ȶ��� | ���� |
| 101�桫102�� | 150�桫160������ | 100.1��ֽ��ˮ��175��ֽ��CO2��CO��H2O | �� Ca(OH)2��Ӧ������ɫ����(CaC2O4) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
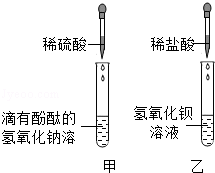
| | NaHCO3��Һ | NaOH��Һ | Na2CO3��Һ |
| �����̪��Һ | ��Һ��� | ����� | ��Һ��� |
| ����CuSO4��Һ | �������ݺ���ɫ���� | ����� | �������ݺ���ɫ���� |
| ����CaCl2��Һ | �����Ա仯 | �����Ա仯 | ������ɫ���� |
| ������Һ�����ڣ��� ����ͨ�����ʯ��ˮ | ����ʯ��ˮ ����� | ����ʯ��ˮ �����Ա仯 | ����ʯ��ˮ �����Ա仯 |
| ʵ����� | ʵ������ | ʵ����� |
| ���� �� �� | ���� �� �� | ��Һ�е�������Na2CO3��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
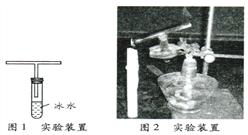
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
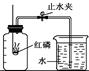
| | ��ɫ��״̬ | �۵�/�� | �Ż��/�� | �ܶ�/(g/cm3) |
| ���� | ����ɫ���� | 590 | 240 | 2��34 |
| ���� | ��ɫ���ɫ���� | 44��1 | 40 | 1��82 |
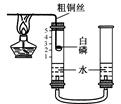
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
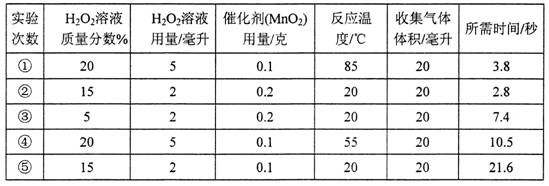
| A���ٺ͢� | B���ں͢� | C���ۺ͢� | D���ٺ͢�E.�ں͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
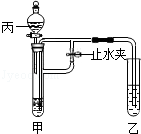
 2NH3�������е�������ʵ�飮��װ�â��Ҳർ��ͨ�뵪������ർ��ͨ����������װ�â��м����ҩƷ�� ��װ�â��м���Ũ���ᣬ��װ�â�������У��� ����ʹ������������ֻ�ϣ���ͨ���۲� ���������������ȣ��Ӷ���ߵ����������������ʣ�
2NH3�������е�������ʵ�飮��װ�â��Ҳർ��ͨ�뵪������ർ��ͨ����������װ�â��м����ҩƷ�� ��װ�â��м���Ũ���ᣬ��װ�â�������У��� ����ʹ������������ֻ�ϣ���ͨ���۲� ���������������ȣ��Ӷ���ߵ����������������ʣ�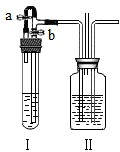
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com