
【题目】将100g氯化钙样品(含有碳酸钙)加入150g盐酸中完全反应,气体全部逸出,得到245.6g溶液。则:
(1)产生的气体质量为________g。
(2)反应后溶液中溶质的质量分数________。 (计算结果保留一位小数)
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:初中化学 来源: 题型:
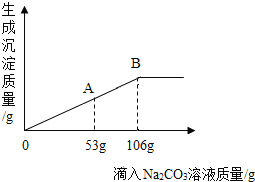
【题目】在一烧杯中盛有一定质量的BaCO3固体,向其中加入溶质质量分数为10%的稀盐酸,至恰好完全反应,得到113.7g 不饱和溶液,向所得溶液中逐滴加入质量分数为10%的Na2CO3溶液,生成沉淀质量与所滴入Na2CO3溶液的质量关系曲线如图所示,请根据题意回答问题:
(1)在加入稀盐酸的过程中,观察到的明显实验现象是_____。
(2)当加入Na2CO3溶液至图中A 点时,烧杯中溶液里含有的溶质是_____ (写化学式)。
(3)当加入Na2CO3溶液至图中B 点时,求此时所得不饱和溶液的溶质质量分数_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
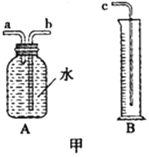
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】绿水青山就是金山银山”的环保理念正深入人心。为防范“污染在水中,问题在岸上。”环境监测人员适时对河水质量进行监测,监测项目有:悬浮物、pH、化学需氧量等指标。
(1)悬浮物是指悬浮在水中的固体物质,除去水中悬浮物的方法是_____________。
(2)实验室用pH试纸检测河水pH的操作是____________________________________。
(3)检测河水化学需氧量需要用到硫酸亚铁铵滴定液,其配制方法是:称取20g硫酸亚铁铵溶解在100g水中后,用玻璃棒边搅拌边缓慢加入20g浓硫酸,再加入860g的水稀释。
①往硫酸亚铁铵溶液加人浓硫酸时,用玻璃棒边搅拌边缓慢加入的目的是________。
②上述方法配制的硫酸亚铁铵滴定液中硫酸亚铁铵的溶质质量分数为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,打开止水夹,将液体A滴入试管②中与固体B 接触。若试管①中的导管口没有气泡产生,则液体A和固体B的组合可能是下列中的
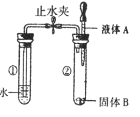
A. 过氧化氢溶液和二氧化锰B. 水和硝酸铵
C. 水和氢氧化钠D. 稀盐酸和石灰石
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1℃时,向盛有10mL水的A、B两支试管中分别加入等质量的甲、乙两种可溶性固体,充分溶解后,观察到如图1所示的现象。请回答:
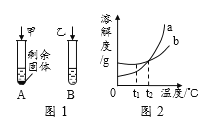
(1)t1℃时,____试管中的溶液一定是饱和溶液。
(2)图2中表示乙物质溶解度曲线的是_______。
(3)若甲物质中混有少量的乙物质,提纯甲物质可以采取的方法是 ___________________。
(4)关于两支试管中的物质,下列说法不正确的是______。
A.t1℃时,试管A上层清液溶质质量分数<试管B中溶质质量分数
B.保持温度不变,向试管A中加入一定质量的水,则溶液中溶质质量分数一定变大
C.若温度升高到t2℃,两支试管中溶质质量分数一定相等(不考虑水分蒸发)
D.蒸发一定质量的水,两支试管中都一定有固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据实验室制取气体的有关知识,结合下列装置图回答问题:

(1)仪器①的名称是________。
(2)实验室收集CO2不选用装置C的原因是________,检验二氧化碳时发生反应的化学方程式为________。
(3)小明组装B、C制取氧气时,B中一直有气泡产生。而C中集气瓶内始终无法把水完全排尽,你认为小明缺少的操作是 ________。
(4)实验室若用锌粒和稀硫酸制取氢气,应选择的装置组合为________(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。某研究小组采用如图实验流程用Na2CO3溶液吸收SO2制备Na2SO3。
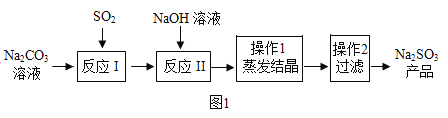
反应I中随着SO2的增加,依次发生如下化学反应:
SO+H2O+2Na2CO3=Na2SO3+2NaHCO3
SO2+2NaHCO3=Na2SO3+2CO2↑+H2O
SO2+H2O+Na2SO3=2NaHSO3
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为_____。
(2)常用蒸发结晶的方法分离混合溶液得到Na2SO3,由此可知,Na2SO3的溶解度曲线是与题图2中的_____(填A或B)物质的溶解度曲线相似。
(3)操作2得到的滤液中一定含有的溶质的化学式为_____。
(4)查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图2所示。则线1表示_____(填化学式,下同)的质量分数的变化情况,线2表示_____的质量分数的变化情况。
(5)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的 NaHSO3转化为Na2SO3,则该化学反应方程式为_____。
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,则Na2SO3样品变质为Na2SO4的化学反应方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图一、图二是元武同学探究金属、酸的化学性质时所做的两组实验.实验结束后,他将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
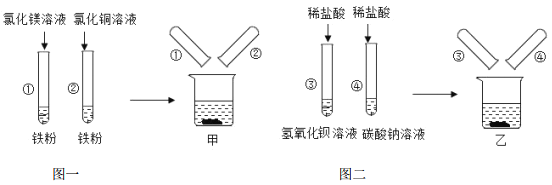
(1)甲烧杯中的物质完全反应后,发现红色固体物质明显增多.下列说法正确的是_____(填序号)
A 试管②反应后的固体中一定不含铁
B 完全反应后,甲烧杯中的固体一定含有铁
C 完全反应后,甲烧杯的溶液中可能含有Cu2+
D 完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+
(2)乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象.你认为乙烧杯的溶液中的溶质成分共有几种 可能猜想:______.
(3)逮杨同学提出乙烧杯中的溶质成分应该有 NaCl、NaOH、Na2CO3.为了验证他的猜想是正确,因此他与翁翁同学将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究来确定他的猜想是正确的:
限选试剂:稀盐酸、硝酸钡、氢氧化钙、硝酸银、酚酞溶液
实验操作 | 实验现象 | 实验结论 |
步骤1:取少量滤液于试管中,_____. | _____ | _____ |
步骤2:_____ | _______ | __________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com