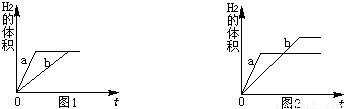解:
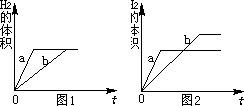
(1)由图1可知,相同反应时间内,a产生氢气的体积大于b,可判断a代表金属活动性强的锌,因其金属活动性比铁强与稀硫酸反应比铁更剧烈;若要使b线向a线靠拢,即加快铁的反应速率,可采取增大铁与稀硫酸的接触面积或反应时的温度等可行性措施,将铁片换成铁粉或适当加热;
(2)A、铁和锌均过量,酸不足,此时充分反应后等质量的锌、铁反应放出氢气质量相等,与图1相符;
B、铁正好完全反应,锌过量,等质量的锌消耗硫酸的质量小于铁,因此铁正好完全反应时锌量不足而不会出现剩余;该情况不可能出现;
C、锌和铁都没有剩余,酸过量,此时锌与硫酸反应放出氢气质量小于铁反应放出氢气的质量,与图2相符;
D、锌和铁都有剩余,且剩余固体质量相等,即消耗相同质量的锌与铁,该情况不可能出现;
(3)图1表示,反应完成后锌与铁所放出氢气质量相等,由于等质量的锌完全反应放出氢气质量小于等质量的铁,因此只有在稀硫酸完全反应时才能出现图1的结果,即金属锌恰好完全反应或过量而铁过量,设与稀硫酸恰好完全锌的质量为m,则
Zn+H
2SO
4═ZnSO
4+H
2↑
65 98
m 100g×9.8%
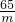
=
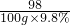
x=6.5g,即m的取值大于或等于6.5g;
图2表示两种金属完全反应时,铁放出氢气的质量大于锌,在等质量金属完全反应即稀硫酸足量或过量时会出现这种情况,根据100g溶质质量分数均为9.8%的稀硫酸只能与6.5g锌反应,因此,此时金属质量m的取值应小于6.5g;
故答案为:
(1)锌;锌的金属活动性(活泼性)比铁强;将铁片换成铁粉(或适当加热)(如写成铁片搅拌或增大盐酸浓度,不能得分);
(2)A;C;
(3)m≥6.5;m<6.5.
分析:根据金属活动性强弱关系锌>铁>氢,锌、铁都能与酸反应而产生氢气,但锌的活动性比铁强,与酸反应更剧烈放出氢气速率更大,由于锌的相对原子质量比铁大,相等质量的锌完全反应放出氢气质量小于等质量的铁.
点评:金属锌的活动性比铁强,与酸反应时比铁剧烈,反应放出氢气的速率大于铁;但等质量的锌完全反应放出氢气的质量小于等质量铁完全反应放出氢气的质量.

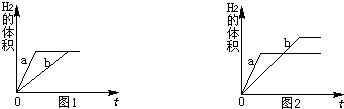
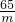 =
=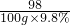 x=6.5g,即m的取值大于或等于6.5g;
x=6.5g,即m的取值大于或等于6.5g;