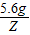某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A.Zn
B.Cu
C.Mg
D.Ag
【答案】
分析:铜、银在金属活动性顺序中,排在氢的后面,不能和稀硫酸反应;
根据化学方程式计算,可以判断混合物的组成.
解答:解:铜、银不能和稀硫酸反应;
解:设5.6g铁与足量的稀硫酸充分反应生成氢气的质量为X,
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
5.6g X
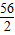
=
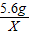
X=0.2g;
解:设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y,
Zn+H
2SO
4═ZnSO
4+H
2↑
65 2
5.6g Y

=
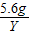
Y=0.17g,
解:设5.6g镁与足量的稀硫酸充分反应生成氢气的质量为Z,
Mg+H
2SO
4═MgSO
4+H
2↑
24 2
5.6g Z
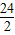
=
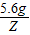
Z=0.47g,
由以上计算可知,当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,
当5.6g纯锌与足量稀硫酸反应时能够生成0.17g氢气,
当5.6g纯镁与足量稀硫酸反应时能够生成0.47g氢气,
由此可知,不纯的铁5.6g中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,
不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是镁.
故选:C.
点评:解答本题要注意临界点,即以5.6g为纯铁时为基础,计算出生成氢气的质量,然后再通过计算判断出杂质是什么物质.

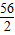 =
=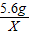
 =
=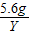
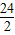 =
=