
 2CuO化学反应,此化学反应属于______类型,可能观察到的现象为______,装置C的作用是______.
2CuO化学反应,此化学反应属于______类型,可能观察到的现象为______,装置C的作用是______.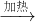 2CuO反应是两种物质生成一种物质的化合反应,可以观察到的现象为:红色固体逐渐变成黑色固体.
2CuO反应是两种物质生成一种物质的化合反应,可以观察到的现象为:红色固体逐渐变成黑色固体.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:初中化学 来源: 题型:
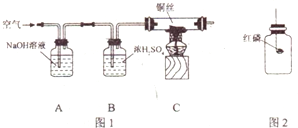
 27、某学习小组将“从空气中制取氮气”作为研究课题,以下是他们的实验方案:
27、某学习小组将“从空气中制取氮气”作为研究课题,以下是他们的实验方案:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 15、某学习小组将“从空气中制取氮气”作为研究课题,以下是他们的实验方案:
15、某学习小组将“从空气中制取氮气”作为研究课题,以下是他们的实验方案:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com