
【题目】写出下列反应的化学方程式:
(1)木炭高温还原氧化铜:________________ 。
(2)铝在空气中被氧化,生成致密的氧化铝(Al2O3)薄膜:___________。
(3)铝片投入氢氧化钠溶液中,反应生成偏铝酸钠(NaAlO2)和氢气(H2):_______。
科目:初中化学 来源: 题型:
【题目】测定反应后溶液成分
查阅资料:将二氧化碳气体慢慢地通入一定量的氢氧化钠溶液中,在溶液中先后发生以下两个化学反应:
2NaOH + CO2 = Na2CO3 + H2O (先发生反应)
Na2CO3+ CO2+ H2O = 2NaHCO3 (后发生反应)
某兴趣小组开展了以下探究活动。
将二氧化碳气体慢慢地通入一定量的氢氧化钠溶液中,再将反应后所得溶液A按下列流程进行实验并测出相关数据:
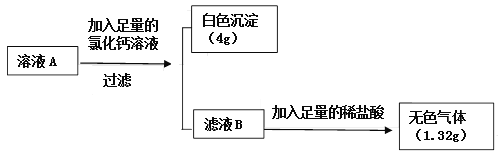
小资料: 碳酸氢盐绝大多数易溶于水, 如 Ca(HCO3)2易溶。
【获得结论】
(1)定性分析:根据上述现象,可确定溶液A中溶质成分为______________(写化学式)。
(2)定量计算:计算溶液A中各溶质的质量为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法
(1)实验室制取气体时,确定发生装置需要考虑的两种因素有_______(填序号)
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
(2)某实验室的仪器柜里有如下仪器:
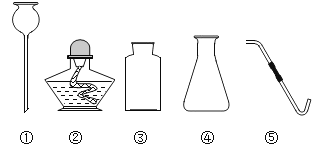
仪器①的名称是________,实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是______(填序号)
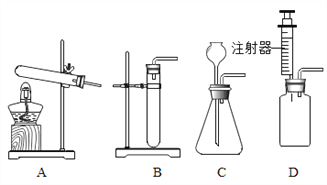
(3)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为________.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是_______(填序号),该装置的最大优点是_______.该装置还可以用于实验室制取________.
(4)若用50克稀盐酸与10克大理石(含杂质)恰好完全反应生成2.2克二氧化碳,求稀盐酸的质量分数__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在电缆产生过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。
(1)请完成该反应的化学方程式:2Cu+2H2SO4+O2![]() 2CuSO4+2_______
2CuSO4+2_______
(2)若选用的稀硫酸溶质的质量分数为20%,则用50g质量分数为98%的浓硫酸配制该稀硫酸,需加水_____g。
(3)某化工厂现有含铜为80%的废铜屑(假设废铜屑中杂质不参加反应),试计算制取80kg硫酸铜需要废铜屑的质量(写出计算过程及结果)____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是高温下某反应的微观过程.下列说法中正确的是( )
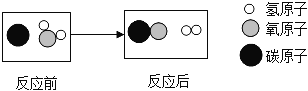
A. 该反应属于复分解反应 B. 该反应中元素的化合价没有变化
C. 图中的两种化合物都属于氧化物 D. 该反应所得生成物的质量比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法不正确的是
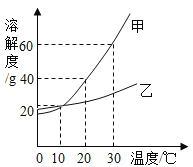
A.10 ℃ 时,甲、乙两种物质的饱和溶液浓度相同
B.保持20 ℃ ,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液
C.30 ℃ 时,将40g 甲物质加人50g水中,充分溶解后溶液的质量为80g
D.10 ℃ 时,将两种饱和溶液升温至30 ℃ ,溶液中溶质的质量分数都增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是实验室制取气体和收集气体的实验装置,根据装置图回答下列问题。
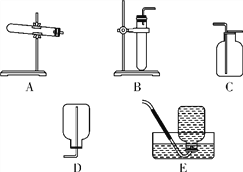
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择______(填编号)装置中还缺少的玻璃仪器是__________。
(2)实验室用过氧化氢与二氧化锰制取氧气,其反应的化学方程式为__________。为了便于观察氧气是否集满,应选用的收集装置是______(填编号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文,回答问题。
桐油是一种天然的植物油,主要成分为α-桐酸(化学式C18H30O2)和三油精,是油桐树果实经机械压榨,加工提炼制成的。它具有良好的防水性、迅速干燥、耐高温、耐腐蚀等特点。桐油又分生桐油和熟桐油两种,生桐油用于医药和化工;熟桐油由生桐油加工而成,可代替清漆和油漆等涂料, 桐油使美丽而充满古韵的油纸伞能遮风避雨。从直观上判断,熟桐油较生桐油粘稠,且颜色呈深咖啡色。
2010年《中国宁德水密隔舱福船制造技艺》被列入世界级非物质文化遗产名录”。造船除木料外,辅助材料有船钉、桐油灰、竹丝、油漆等。桐油灰属无机胶凝材料,明《天工开物》一书中有关于在古建筑中用桐油--石灰作为腻子的记载。桐油灰中熟桐油和生石灰(主要成分氧化钙)的比例是1:3。木船的缝隙用桐油石灰填充,起胶合作用,将木船的每块船板粘贴成一个整体,不会从船底里渗水,木船就可以在水中启航。

请根据文章内容回答下列问题:
(1)油桐树果实经机械压榨提炼桐油的过程是_____(填“物理”或“化学”)变化。
(2)写出桐油石灰的原料之一氧化钙中钙离子符号_____。
(3)如何区分熟桐油与生桐油_____。
(4)在古建筑中用作腻子原料的桐油──石灰属于_____(填“纯净物”或“混合物”)。
(5)α-桐酸(化学式C18H30O2)中氢元素与氧元素的质量比为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示:甲试管中盛有干燥白磷,乙试管中盛有干燥红磷,同时放置在盛有80℃水的烧杯里(甲、乙试管均套有气球密封)。过一会儿后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧。
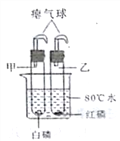
(1)请根据实验现象,对比写出可燃物燃烧所需的条件之一?________________
(2)和课本上“探究燃烧的条件实验”相比,本实验有何优点(任写1条)?_____________
(3)有同学认为甲、乙试管的质量均未发生变化,都符合质量守恒定律,你是否认同?并说明原因。_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com