


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
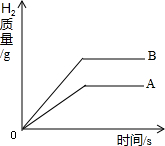 等质量两种金属A、B与足量稀硫酸反应时都生成了+2价的硫酸盐,其产生H2的质量与反应时间的函数关系如图所示.
等质量两种金属A、B与足量稀硫酸反应时都生成了+2价的硫酸盐,其产生H2的质量与反应时间的函数关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:
 将等质量、颗粒大小相同的X、Y、Z三种金属分别投入到相同浓度的足量的稀硫酸中,生成氢气的质量与时间的关系如图所示.已知它们在化合物中均显+2价,则下列说法不正确的是( )
将等质量、颗粒大小相同的X、Y、Z三种金属分别投入到相同浓度的足量的稀硫酸中,生成氢气的质量与时间的关系如图所示.已知它们在化合物中均显+2价,则下列说法不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com