(1)实验室中要配制溶质质量分数为19.6%的稀硫酸200g,需要溶质质量分数为98%的浓硫酸的质量是多少?
(2)用上述配制的稀硫酸来测定某氢氧化钠溶液的质量分数.向80g滴有酚酞试液的该氢氧化钠溶液中逐滴滴加溶质质量分数为19.6%的稀硫酸,当红色恰好变成无色时,消耗稀硫酸的质量为50g.求氢氧化钠溶液中溶质的质量分数.
解:(1)溶液在稀释前后溶液中溶质的质量分数不变,
设需要溶质质量分数为98%的浓硫酸的质量是x,则:
200g×19.6%=x?98%
解得:x=40g
(2)在红色恰好变为无色时,氢氧化钠和硫酸恰好完全反应,此时消耗硫酸的质量为:50g×19.6%=9.8g
设氢氧化钠的质量为y
H
2SO
4+2NaOH═Na
2SO
4+2H
2O
98 80
9.8g y
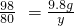
解得:y=8g
氢氧化钠溶液中溶质的质量分数为:
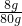
×100%=10%
答:(1)需要溶质质量分数为98%的浓硫酸的质量是40g;
(2)氢氧化钠溶液中溶质的质量分数为10%.
故答案为:(1)40g;
(2)10%.
分析:(1)在稀释溶液前后,溶质的质量不变,可以据此来解答该题;
(2)向氢氧化钠溶液中滴加稀硫酸,它们要发生中和反应,当红色恰好消失时即为氢氧化钠和硫酸恰好完全反应的时刻,故可以据此解答该题.
点评:本题主要是有关溶质质量分数的计算及根据化学方程式进行的有关计算,在解答溶液的稀释问题时要注意根据在溶液稀释前后溶质的质量不变来进行解答.

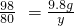
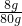 ×100%=10%
×100%=10%
