
 x=12.7g
x=12.7g

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省南京市联合体(栖霞下关雨花台等)九年级中考一模化学试卷(解析版) 题型:探究题
某校化学兴趣小组将一根光亮的细铁丝均分为三份,绕成相同的形状用下图所示装置对铁生锈的条件进行了探究。

请回答:
(1)A中反应的化学方程式为 ;
(2)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为 ;
(3)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮。说明铁生锈主要与 、 有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
某校化学兴趣小组将一根光亮的细铁丝均分为三份,绕成相同的形状用下图所示装置对铁生锈的条件进行了探究。
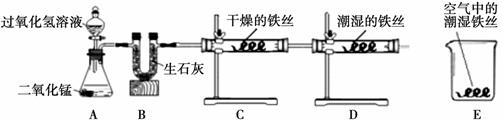
请回答:
(1)A中反应的化学方程式为 ▲ ;
(2)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为 ▲ ;
(3)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮。说明铁生 锈主要与 ▲ 、 ▲ 有关。
锈主要与 ▲ 、 ▲ 有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是 ▲ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
某校化学兴趣小组将一根光亮的细铁丝均分为三份,绕成相同的形状用下图所示装置对铁生锈的条件进行了探究。
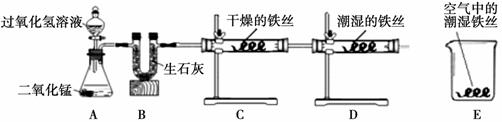
请回答:
(1)A中反应的化学方程式为 ▲ ;
(2)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为 ▲ ;
(3)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮。说明铁生锈主要与 ▲ 、 ▲ 有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com