
(10分)已知2Al+Fe2O3 === 2Fe+Al2O3 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。从反应中可以看出Al比Fe活泼,镁和氧化铜也能发生类似的反应。该反应的化学方程式为 。某活动小组在实验室中进行镁和氧化铜的反应,充分反应之后,大家对于反应后的固体剩余物产生了疑问,请你帮助他们完成探究实验。
【提出问题】
反应后的固体剩余物是什么?
【做出假设】
甲组同学经过讨论一致认为:反应后的固体剩余物中一定含有 和 。对于可能含有的物质他们做出了如下假设:乙组同学认为可能含 ;丙 组同学认为可能含 。
【实验探究】
经过查阅资料、回忆已学过的知识,大家决定设计如下的实验对反应后的固体剩余物进行探究。
|
实验操作 |
实验现象 |
实验结论 |
|
①取少量反应后的固体剩余物于试管中,向其中加入足量的 。 |
固体部分溶解,溶液为无色。 |
甲组同学的结论正确。 |
|
②另取少量固体于试管中,进行与实验①一样的操作。 |
|
乙组同学的假设成立。 |
|
③另取少量固体于试管中,进行与实验①一样的操作。 |
|
丙组同学的假设成立。 |
【反思与拓展】
对于有多种物质参加的化学反应,要判断充分反应后得到的剩余物的成分,需要考虑到 。由此联想到:在盐酸和氢氧化钠溶液发生的中和反应后的剩余溶液中滴入无色酚酞试液,若酚酞试液不变红,则反应 恰好完全反应(填“一定”或“不一定”)。
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:初中化学 来源: 题型:阅读理解
(10分)已知2Al+Fe2O3=== 2Fe+Al2O3在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。从反应中可以看出Al比Fe活泼,镁和氧化铜也能发生类似的反应。该反应的化学方程式为 。某活动小组在实验室中进行镁和氧化铜的反应,充分反应之后,大家对于反应后的固体剩余物产生了疑问,请你帮助他们完成探究实验。
【提出问题】
反应后的固体剩余物是什么?
【做出假设】
甲组同学经过讨论一致认为:反应后的固体剩余物中一定含有 和 。对于可能含有的物质他们做出了如下假设:乙组同学认为可能含 ;丙组同学认为可能含 。
【实验探究】
经过查阅资料、回忆已学过的知识,大家决定设计如下的实验对反应后的固体剩余物进行探究。
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量反应后的固体剩余物于试管中,向其中加入足量的 。 | 固体部分溶解,溶液为无色。 | 甲组同学的结论正确。 |
| ②另取少量固体于试管中,进行与实验①一样的操作。 |
| 乙组同学的假设成立。 |
| ③另取少量固体于试管中,进行与实验①一样的操作。 |
| 丙组同学的假设成立。 |
【反思与拓展】
对于有多种物质参加的化学反应,要判断充分反应后得到的剩余物的成分,需要考虑到 。由此联想到:在盐酸和氢氧化钠溶液发生的中和反应后的剩余溶液中滴入无色酚酞试液,若酚酞试液不变红,则反应 恰好完全反应(填“一定”或“不一定”)。
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省泰兴市实验初级中学初三期末考试化学试卷(带解析) 题型:探究题
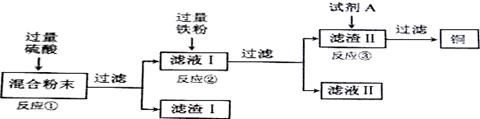
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 . |
| ②取步骤①所得滤渣,加过量的_________,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 . |
查看答案和解析>>
科目:初中化学 来源:2013届江苏省泰兴市初三期末考试化学试卷(解析版) 题型:探究题
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
|
实验方案 |
实现现象 |
结论 |
|
①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. |
合金中一定含有 . |
|
②取步骤①所得滤渣,加过量的_________,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. |
合金中一定含有 . |
【探究结论】猜想3成立.
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com