解:
(1)遇酸及酸性药物则产生二氧化碳,说明含有碳酸根离子或碳酸氢根离子,水溶液呈弱碱性,说明是强碱弱酸盐,灼烧时火焰为黄色,说明含有钠离子,白色结晶状粉末,受热可缓缓分解,碳酸钠不会分解,所以只能是碳酸氢钠;可溶于稀酸或氢氧化钠溶液中,该物质是一种两性碱,凝胶本身覆盖于溃疡面上,具有保护作用,说明该物质遇水会生成胶状物质,所以该物质是氢氧化铝,故答案为:NaHCO
3;Al(OH)
3;
(2)碳酸氢钠和盐酸的反应实质就是碳酸氢根离子和氢离子会生成水的反应,故答案为:HCO
3-+H
+═H
2O+CO
2↑;
(3)镁元素显+2价,硅元素显+4价,氢元素显+1价,氧元素显-2价,氧化物中只有氧和另一种元素,故答案为:2MgO?3SiO
2?nH
2O;
三硅酸镁和盐酸反应生成氯化镁、硅酸和水,故答案为:Mg
2Si
3O
8?nH
2O+4HCl=2MgCl
2+3H
2SiO
3↓+(n-1)H
2O;
(4)标准状况下224mL气体的物质的量是:
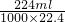
=0.01mol,
设生成0.01mol的二氧化碳需要碳酸镁物质的量是x,消耗盐酸物质的量是y,生成氯化镁物质的量是z,
MgCO
3+2HCl=MgCl
2+H
2O+CO
2↑
1 2 1 1
x y z 0.01
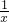
=
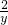
=
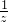
=
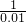
x=0.01mol y=0.02mol z=0.01mol
MgCl
2+2NaOH=2NaCl+Mg(OH)
2↓ Mg(OH)
2
MgO+H
2O
从方程式中可以看出氧化镁的物质的量和氯化镁的物质的量是相当的,
氧化镁物质的量:
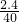
=0.06mol,所以氯化镁物质的量也是0.06mol;碳酸镁生成0.01mol的氯化镁,所以氢氧化镁生成0.05mol的氯化镁,
设生成0.05mol的氯化镁需要氢氧化镁m,消耗盐酸n,
Mg(OH)
2+2HCl=MgCl
2+2H
2O
1 2 1
m n 0.05mol
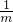
=
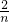
=
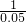
m=0.05mol n=0.1mol
所以与氢氧化铝反应的盐酸物质的量是:
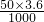
-0.1-0.02=0.06mol,
Al(OH)
3+3HCl=AlCl
3+3H
2O,从方程式中可以看出氢氧化铝和盐酸的物质的量的比值是1:3,所以氢氧化铝的物质的量是:0.02mol,
故答案为:
n(MgCO
3):n(Mg(OH)
2):n(Al(OH)
3)=1:5:2
分析:(1)根据遇酸及酸性药物则产生二氧化碳,说明含有碳酸根离子或碳酸氢根离子,水溶液呈弱碱性,说明是强碱弱酸盐,灼烧时火焰为黄色,说明含有钠离子,白色结晶状粉末,受热可缓缓分解,碳酸钠不会分解,所以只能是碳酸氢钠;
根据可溶于稀酸或氢氧化钠溶液中,该物质是一种两性碱,凝胶本身覆盖于溃疡面上,具有保护作用,说明该物质遇水会生成胶状物质,所以该物质是氢氧化铝;
(2)根据离子方程式的书写原则进行分析;
(3)根据镁元素、硅元素、和氢元素的化合价以及氧化物的定义进行书写;
根据题中的叙述找出反应物、生成物书写方程式;
(4)根据标准状况下224mL气体,计算出二氧化碳的摩尔数,依据二氧化碳的摩尔数计算出碳酸镁的物质的量,根据Mg(OH)
2在高温下分解为MgO,取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g可知,所以2.4克固体是氧化镁,计算出氧化镁的物质的量,在计算出氯化镁物质的量,就可以得到氢氧化镁物质的量,进而计算消耗盐酸物质的量,通过盐酸物质的量就可以得到氯化铝物质的量.
点评:在解此类题时,首先读懂题意,然后结合学过的知识和题中的知识进行解答,需要注意物质的量的求解.

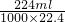 =0.01mol,
=0.01mol,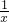 =
=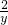 =
=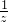 =
=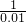
 MgO+H2O
MgO+H2O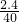 =0.06mol,所以氯化镁物质的量也是0.06mol;碳酸镁生成0.01mol的氯化镁,所以氢氧化镁生成0.05mol的氯化镁,
=0.06mol,所以氯化镁物质的量也是0.06mol;碳酸镁生成0.01mol的氯化镁,所以氢氧化镁生成0.05mol的氯化镁,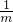 =
=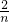 =
=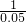
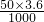 -0.1-0.02=0.06mol,
-0.1-0.02=0.06mol,

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案