
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②⑤ |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
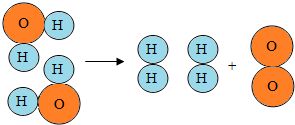 如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )| A. | 一个水分子由二个氢原子和一个氧原子构成 | |
| B. | 水分解过程中,分子的种类不变 | |
| C. | 水分解后生成氢气和氧气 | |
| D. | 水分解过程中,原子的数目不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
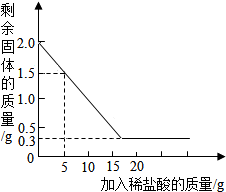 某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5克 | 1.5克 |
| 第二次加入5克 | 1.0克 |
| 第三次加入5克 | 0.5克 |
| 第四次加入5克 | 0.3克 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 自然界中二氧化碳处于循环状态 | |
| B. | 二氧化碳气体能使紫色石蕊试液变红 | |
| C. | 干冰可用于储藏食物和人工降雨 | |
| D. | 可用氢氧化钠溶液检验二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | m(KClO3)/g | m(MnO2)/g | m(CuO)/g | 回收催化剂质量/g |
| ① | 0.6000 | -- | -- | -- |
| ② | a | 0.2000 | -- | 0.1950 |
| ③ | b | -- | c | 0.1900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com