
| A. | 40% | B. | 50% | C. | 84% | D. | 96% |
分析 根据碳酸钙的质量可以计算钙元素的质量,进一步可以计算CaH2与Ca的混合物中氢元素的质量,从而可以计算样品中CaH2的质量分数.
解答 解:钙元素的质量为:2.4g×$\frac{40}{100}$×100%=0.96g,
则CaH2与Ca的混合物中氢元素的质量为:1g-0.96g=0.04g,
则CaH2的质量为:0.04g÷($\frac{2}{42}$×100%)=0.84g,
则样品中CaH2的质量分数为:$\frac{0.84g}{1g}$×100%=84%,
故选:C.
点评 CaH2与Ca的混合物中的钙元素完全转化到碳酸钙中,根据碳酸钙的质量可以计算钙元素的质量,进一步可以计算氢元素和CaH2的质量,要注意理解.


科目:初中化学 来源: 题型:解答题
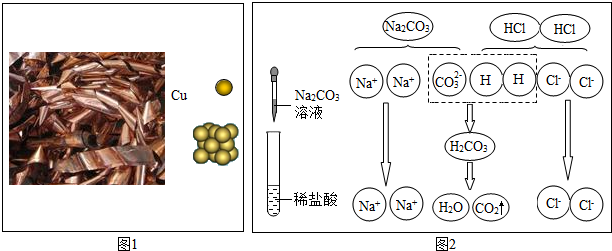
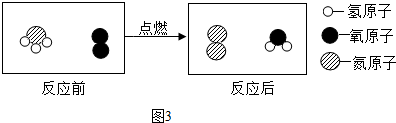
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
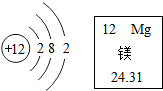 农作物必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等.
农作物必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
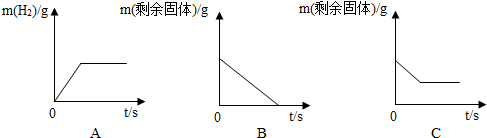
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com