
| A. | 称取10.0g氯化钠,放入90ml水中,搅拌 | |
| B. | 称取10.0g生石灰,放入90ml水中,充分搅拌 | |
| C. | 量取10.0ml浓盐酸,放入90ml水中,搅拌 | |
| D. | 称取10.0g硫酸钡,放入90ml水中,充分搅拌 |
分析 根据溶质质量分数=$\frac{溶质质量}{溶液质量}×$100%,结合题意进行分析判断即可.
解答 解:A、称取10.0g氯化钠,放入90mL水中,充分搅拌,所得溶液质量分数:$\frac{10g}{90mL×1g/mL+10g}$×100%=10%,故选项正确.
B、生石灰与水反应生成氢氧化钙,溶质为氢氧化钙,氢氧化钙微溶于水,则所得溶质质量分数一定小于10%,故选项错误.
C、不知道浓盐酸的密度,无法算浓盐酸的质量,不能计算溶质质量分数,故选项错误.
D、硫酸钡难溶于水,放到水中不能形成溶液,故选项错误.
故选:A.
点评 本题难度不大,掌握溶质质量分数=$\frac{溶质质量}{溶液质量}×$100%、常见物质的溶解性等是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若Fe 粉完全溶解,则混合溶液中只含有溶质Fe(NO3)2、Zn(NO3)2 | |
| B. | 若铁粉部分溶解,则滤渣中肯定含有Fe、Ag、Cu、Zn | |
| C. | 若溶液中只含有Fe(NO3)2、Zn(NO3)2,则滤渣中可能含有Fe | |
| D. | 若滤渣中含有金属Cu,则Fe 粉已完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 根据某元素的原子结构示意图推断该元素原子核内的中子数 | |
| B. | 根据酸、碱、盐的溶解性表可推知离子间能否在溶液中共存 | |
| C. | 根据元素的相对原子质量表查出某元素的质量 | |
| D. | 根据元素周期表查出某元素在地壳中的含量9 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
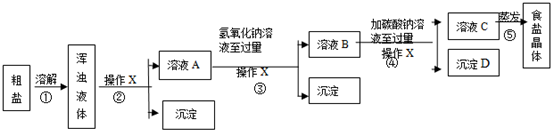
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
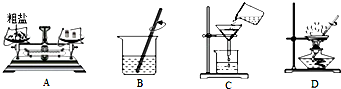
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com