
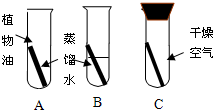
 (B组)铜锈的主要成分是铜绿[Cu2(OH)2CO3],某同学为了探究铜片在空气中生锈的原因,利用下图所示A、B、C装置进行实验,经过近一个月的观察,该同学会发现________中的铜片生锈,而________中铜片无明显变化.
(B组)铜锈的主要成分是铜绿[Cu2(OH)2CO3],某同学为了探究铜片在空气中生锈的原因,利用下图所示A、B、C装置进行实验,经过近一个月的观察,该同学会发现________中的铜片生锈,而________中铜片无明显变化. 2CuO+CO2↑+H2O.
2CuO+CO2↑+H2O. 2CuO+CO2↑+H2O.
2CuO+CO2↑+H2O.

科目:初中化学 来源: 题型:
 (2012?天河区一模)(1)CO还原氧化铜的化学方程式是
(2012?天河区一模)(1)CO还原氧化铜的化学方程式是
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)CO还原氧化铜的化学方程式是______.还原产物中往往含有少量红色的氧化亚铜(Cu2O)固体,Cu2O能与稀硫酸发生如下反应:Cu2O+H2SO4=Cu+CuSO4+H2O.检验CO还原氧化铜的还原产物中是否含Cu2O的实验方法是______,产物中含有Cu2O的实验现象是______.
(1)CO还原氧化铜的化学方程式是______.还原产物中往往含有少量红色的氧化亚铜(Cu2O)固体,Cu2O能与稀硫酸发生如下反应:Cu2O+H2SO4=Cu+CuSO4+H2O.检验CO还原氧化铜的还原产物中是否含Cu2O的实验方法是______,产物中含有Cu2O的实验现象是______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com