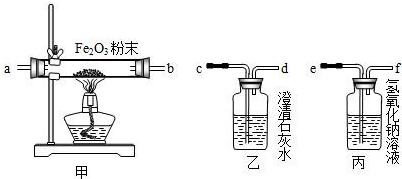
解:【猜想与假设】煤燃烧需要用到空气,空气中含有氮气,氮气虽然没有参加反应,但也混合在了废气中,所以废气中一定不含有N
2的说法是错误的;
【交流与评价】酸雨的形成主要是由于二氧化硫或氮的氧化物造成,当地常降酸雨,说明电厂的燃煤中含有较多的硫元素和氮元素;
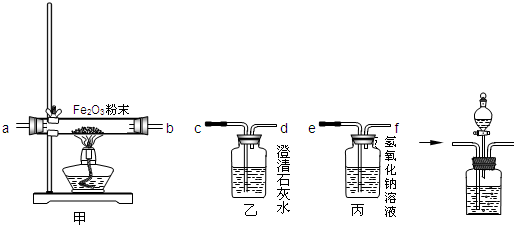
【活动探究】
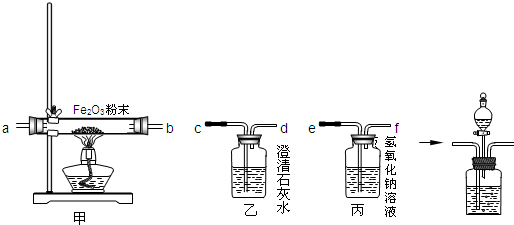
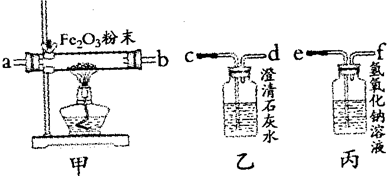
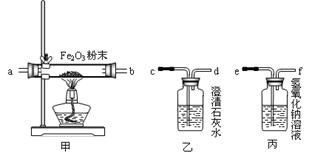
验证一氧化碳需要通过氧化铁生成使澄清石灰水变浑浊的气体来验证,而碳燃烧生成的二氧化碳、二氧化硫都能使澄清石灰水变浑浊,所以先通过氢氧化钠溶液是除去废气中的CO
2、SO
2等气体;一氧化碳与氧化铁反应的反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,用观察法配平,反应条件是高温写在等号的上方;
【实验反思】
(1)由于一氧化碳在发生反应时,有一部分一氧化碳并没有参加反应,而随着尾气排出,由于一氧化碳有毒会污染空气,所以在d处用酒精灯将尾气进行点燃,转化为二氧化碳再进行排放;
(2)将CO
2和CO的混合气体通过盛有氢氧化钠溶液的试剂瓶后,二氧化碳与氢氧化钠反应生成了碳酸钠和水,一氧化碳不反应,直接进行收集即可,再向生成碳酸钠的试剂瓶内加入盐酸或硫酸,与碳酸钠反应又生成二氧化碳,再将二氧化碳收集起来即可.二氧化碳与氢氧化钠反应的反应物是氢氧化钠和二氧化碳,生成物是碳酸钠和水,用观察法配平即可.
故答案为:【猜想与假设】D
【交流与评价】当地常降酸雨,(其他合理叙述均可)
【活动与探究】除去废气中的CO
2、SO
2等气体(或防止CO
2、SO
2等气体对实验的干扰)
3CO+Fe
2O
3
2Fe+3CO
2【反思】(1)在d处用酒精灯将尾气进行点燃;(2)稀硫酸或稀盐酸,氢氧化钠浓溶液 CO
2NaOH+CO
2=Na
2CO
3+H
2O
分析:【猜想与假设】根据煤燃烧需要用到空气考虑;【交流与评价】根据酸雨形成的原因考虑;【活动探究】验证一氧化碳需要通过氧化铁生成使澄清石灰水变浑浊的气体,所以要把原来气体中的二氧化碳、二氧化硫除去考虑;根据方程式的写法写出反应原理;【反思】(1)根据尾气污染空气考虑;(2)根据一氧化碳与二氧化碳的分离方法是先通过试剂后将二氧化碳吸收,得到一氧化碳,再通过加入一种试剂再释放出二氧化碳.
点评:解答本题的关键是要知道在验证一氧化碳存在时必须将原来的二氧化碳和二氧化硫除掉,在分离二氧化碳与一氧化碳时,先将二氧化碳吸收收集到一氧化碳,再通过化学变化将二氧化碳释放出来.

 2Fe+3CO2
2Fe+3CO2